题目内容
【题目】某兴趣小组要测定某石灰石样品中杂质的质量分数。他们进行了如图实验。
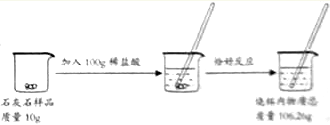
(杂质不发生反应)请计算:
(1)生成CO2气体的质量;
(2)样品中杂质的质量分数。
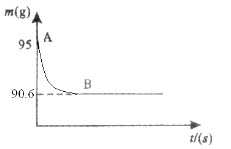
【答案】(1)3.74g (2) 15%
【解析】
试题分析:(1)根据质量守恒定律,可以知道反应后减少的质量即为产生二氧化碳质量。(2)根据二氧化碳的质量,利用化学方程式计算出石灰石样品中碳酸钙的质量,再用石灰石样品的质量减去碳酸钙的质量即为杂质质量,最后用杂质质量除以样品的质量。
解:设样品中碳酸钙的质量为x
根据质量守恒定律知,生成二氧化碳的质量=100g+10g-106.26g=3.74g
CaCO3+ 2 HCl == CaCl2 + CO2↑+ H2O
100 44
x 3.74g
100/44=x/3.74g x=8.5g
所以样品中杂质的质量分数=(10g-8.5g)/10g=15%
答:生成CO2气体的质量为3.74g,
样品中杂质的质量分数为15%

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】“凤凰”号火星探测器圆满完成任务,向地面发回数量堪称史无前例的图像和数据,为人类探索火星提供了宝贵的科学资料。请完成14~16题。
(1)“凤凰”号探测器发回的最新照片上显示,火星上确有液态水存在。下列微粒模型示意图可表示构成水的微粒的是 (填标号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(2)火星上含有丰富的二氧化碳和镁资源。科学家设想,镁可作为未来火星上的燃料,因为镁能在二氧化碳中燃烧放出大量的热,同时生成氧化镁和碳。该反应的化学方程式为 。
(3)火星北极的土壤呈弱碱性。如果火星具备作物生长的条件,下表所列作物较适宜在火星北极种植的有 。
作物名称 | 芦笋 | 草莓 | 萝卜 | 马铃薯 |
适宜生长的pH | 5.5~7.8 | 5.5~6.5 | 5~8 | 5.6~6 |