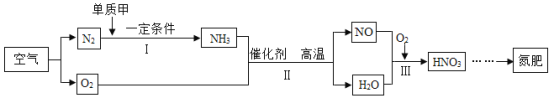
题目内容
【题目】一度被人称为“洋火”的火柴始于我国南北朝时期的发烛、火寸条。火柴头上主要含有氯酸钾、二氧化锰、硫磺和玻璃粉等,火柴盒的侧面涂有红磷、三硫化二锑(Sb2S3)和玻璃粉。
(1)火柴头在火柴盒侧面划动促使磷、三硫化二锑等可燃物燃烧,“划”的作用是__________;三硫化二锑在空气中燃烧生成三氧化二锑和二氧化硫的化学方程式为______________________。
(2)为检验火柴头的成分,进行如图所示的实验(二氧化硫可以使品红试纸和高锰酸钾溶液褪色)。
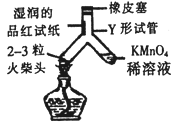
①使用湿润的品红试纸的目的是_______;补全高锰酸钾溶液中反应的化学方程式: 2KMnO4 + 3SO2 + 2H2O = K2SO4 + ____________↓+ 2H2SO4
②将燃尽的火柴头捣碎、加水充分溶解、过滤,向滤液中加足量AgNO3溶液和稀硝酸,生成白色沉淀,说明滤液中含有_____________,从而证明火柴头中含氯元素。
③测得上述反应前火柴头的总质量为a,生成的沉淀物质量为b,则火柴头中氯元素的质量分数为______(只列式不计算)。
【答案】产生热量,使温度达到可燃物的着火点 2Sb2S3 +9 O2 ![]() 2Sb2O3 +6SO2 检验二氧化硫 2MnO2 Cl-(或氯化钾)
2Sb2O3 +6SO2 检验二氧化硫 2MnO2 Cl-(或氯化钾) ![]()
【解析】
磷点燃生成五氧化二磷,三硫化二锑在空气中燃烧生成三氧化二锑和二氧化硫,燃烧条件:物质是可燃物,达到可燃物着火点,有氧气参与,氯化钾和硝酸银反应生成氯化银白色沉淀和硝酸钾。
(1)火柴头在火柴盒侧面划动促使磷、三硫化二锑等可燃物燃烧,“划”的作用是产生热量,使温度达到可燃物的着火点;三硫化二锑在空气中燃烧生成三氧化二锑和二氧化硫的化学方程式为2Sb2S3 +9 O2 ![]() 2Sb2O3 +6SO2。
2Sb2O3 +6SO2。
(2)①使用湿润的品红试纸的目的是检验二氧化硫;根据质量守恒定律,反应前后原子个数不变,高锰酸钾溶液中反应的化学方程式:
2KMnO4 + 3SO2 + 2H2O = K2SO4 +2MnO2↓+ 2H2SO4。
②将燃尽的火柴头捣碎、加水充分溶解、过滤,向滤液中加足量AgNO3溶液和稀硝酸,生成白色沉淀,说明滤液中含有氯化钾,从而证明火柴头中含氯元素。
③测得上述反应前火柴头的总质量为a,生成的沉淀物质量为b,根据元素守恒可知氯酸钾中的氯元素和氯化银中的氯元素质量相等,则火柴头中氯元素的质量分数为![]() 。
。

【题目】下列4个图像不能正确反映对应变化关系的是
|
|
|
|
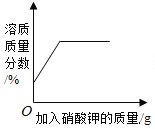
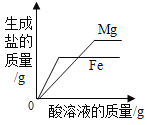
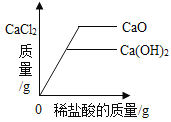
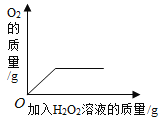
A20°C时,向一定量的硝酸钾不饱和溶液中加人硝酸钾固体 | B向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量 | C等质量CaO和Ca(OH)2中分别加入等浓度 的稀盐酸至过量 | D向 盛有少量二氧化锰的烧杯中不断地加入 过氧化氢溶液 |
A.AB.BC.CD.D