题目内容
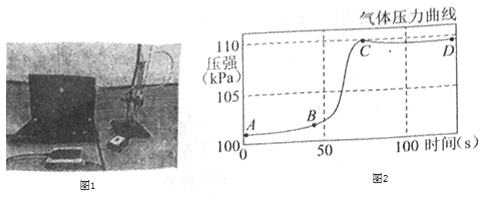
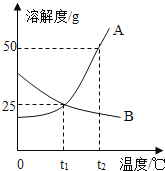
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是()
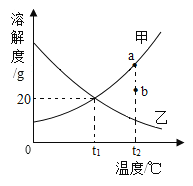
A.t1°C时, 甲、乙两种溶液中溶质的质量相等
B.要将甲溶液的状态由a点转化为b点,可以加适量溶剂
C.t1°C时,100g 甲物质的饱和溶液中溶质的质量是20g
D.分别将t2°C时两种物质的饱和溶液降温至t1°C,均有晶体析出
【答案】B
【解析】
由甲、乙两种物质的溶解度曲线图可知,甲物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而减小。
A、t1℃时,甲、乙两种物质的溶解度相同,甲、乙两种溶液的状态、溶液的质量不能确定,溶液中溶质的质量也就不能确定,故A不正确;
B、a点是甲物质的饱和溶液,b点是甲物质的不饱和溶液,所以要将甲溶液的状态由a点转化为b点,可以加适量溶剂,故B正确;
C、t1℃时,甲物质的溶解度是20g,根据溶解度概念可知,120g甲物质的饱和溶液中溶质的质量是20g,100g 甲物质的饱和溶液中溶质的质量小于20g,故C不正确;
D、乙物质的溶解度随温度的降低而增大,甲物质的溶解度随温度的降低而减小,所以分别将t2℃时两种物质的饱和溶液降温至t1℃,甲物质有晶体析出,乙物质不会有晶体析出,故D不正确。故选B。

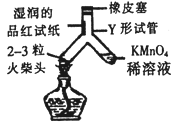
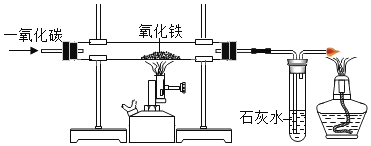
【题目】为验证“加热碳酸氢铵”所发生的变化和产物,两同学分别用甲、乙所示装置进行实验。
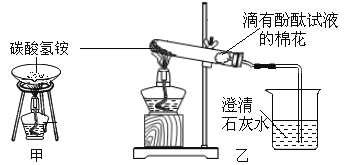
(1)甲实验中的现象是_______________。
(2)乙实验中试管口略向下倾斜的原因是_______________。乙实验中烧杯内反应化学方程式为_______________;实验中棉花逐渐变红色,则可说明反应产物中有_______________;相对于甲实验来说,乙实验的优点有(写一条)_______________。
(二)将一定量的K2CO3溶液与BaCl2溶液混合,过滤反应后的混合物。某兴趣小组的同学们欲探究滤液中溶质的组成。请你一同参与探究并回答有关问题:
[查阅资料]K2CO3溶液显碱性; BaCl2、 KCl溶液显中性。
[提出猜想]猜想1:滤液溶质是KCl;
猜想2:滤液溶质是_______________。
猜想3:滤液溶质是KCl和K2CO3。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
① 取少量滤液于试管中,滴几滴无色酚酞试液,振荡 | 无明显现象 | ①猜想_________不成立 |
② 另取少量滤液于另一支试管中,滴加K2CO3溶液 | ______________ | ②猜想2成立。 写出相关的化学方程式 _____________ |
[问题讨论]小丽同学认为要证明猜想2成立也可改用AgNO3溶液,你认为小丽同学不能达到实验目的,你的理由是_______________。
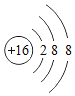
[反思拓展]实验结束后,组内同学认为K2CO3是盐而其水溶液却显碱性,这可能与它的构成微粒有关,微粒符号是_______________。
【题目】溶解度是我们初中化学常见的概念,请回答下列问题。
I.下表是NaC1、KNO3在不同温度下的溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | |
(1)要比较NaC1、KNO3在水中的溶解能力,需要控制的变量是水的质量和_____________________。
(2)从KNO3溶液中获取其晶体适宜的方法是_____________________。
(3)20℃时,各取NaC1、KNO3固体3.5g加入10g水中,充分溶解后达到饱和状态的是___溶液。
(4)若将上述数据在坐标中绘制成NaCl、KNO3的溶解度曲线,两条曲线的交,点对应的温度范围是(_____)
A 0°C~20°C
B 20°C ~40°C
C 40°C ~60°C
D 60°C ~80°C
II.将质量为30g的B物质加入到50g水中,充分搅拌后,剩余物质的质量随温度的关系如图所示,过程中不考虑水分蒸发,回答问题:
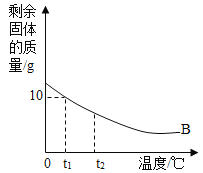
(5)固体B的溶解度随温度的升高而____________(填“增大”或“减小”) 。
(6) t1℃时,B的溶解度是___________。