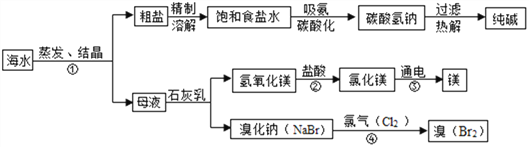
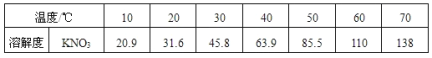
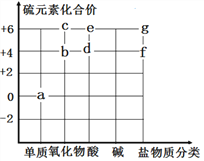
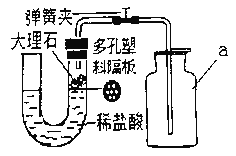
题目内容
【题目】从微观的角度了解物质及其变化,更有助于认识物质组成和变化的本质。
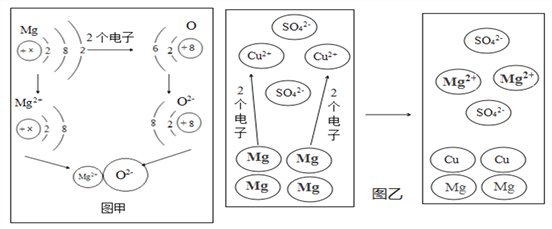
(1)图甲是镁与氧气生成氧化镁的微观示意图。
①反应中镁原子失去2个电子形成镁离子,在此过程中一定不会发生改变的是__________。
A.元素种类 B.元素化学性质 C.最外层电子数 D. 原子核
②下列有关说法不正确的是__________________。
A.每个镁原子失去2个电子形成镁离子,每个氧原子得到2个电子形成氧离子
B.镁离子与氧离子电性相反,相互吸引,形成稳定化合物
C.镁得到氧,化合价降低,发生氧化反应
(2)图乙为镁和硫酸铜溶液反应的微观示意图。由图分析,该反应的微观本质是______________________________________________。金属的活泼性:Mg_______Cu(填<或>)。
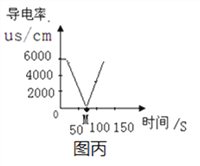
(3)图丙是向20mL1.6%的氢氧化钡溶液中滴加2滴酚酞,逐滴加入2%的硫酸铜溶液时所测得溶液导电率图。写出发生反应的化学方程式______________。该反应的微观本质是_________________。M点过后溶液导电率升高的原因是__________________________。
(4)若化合价发生改变的反应属于氧化还原反应,上述三个反应中属于氧化还原反应的是_________(用甲、 乙、丙 填写)。
【答案】 AD C 每个镁原子失去2个电子形成镁离子,每个铜离子得到2个电子形成铜原子 > Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓ 钡离子与硫酸根离子结合生成硫酸钡沉淀,铜离子与氢氧根离子结合生成物氢氧化铜沉淀 反应结束,硫酸铜过量,溶液中可自由移动的离子数目增多 甲和乙
【解析】本题考查了微粒模型图的应用,原子和离子的相互转化,中和反应的实质,常见元素的化合价,化学方程式的书写等。
(1)①原子得失电子变成离子,核内质子数不变即元素种类不变;得失电子只改变最外层电子数,元素的化学性质改变,原子核不变;故选AD;
②A、根据微观示意图可知,每个镁原子失去2个电子形成镁离子,每个氧原子得到2个电子形成氧离子,正确;B、镁离子带正电,氧离子带负电,电性相反,相互吸引,形成稳定化合物,正确;C、镁与氧气反应,镁元素的化合价由0价变为+2价,化合价升高,发生氧化反应,错误。故选C;
(2)根据镁和硫酸铜溶液反应的微观示意图。由图分析可知,该反应的微观本质是每个镁原子失去2个电子形成镁离子,每个铜离子得到2个电子形成铜原子;金属的活泼性:Mg>Cu;
(3)氢氧化钡与硫酸铜反应生成硫酸钡与氢氧化铜,化学方程式是:Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓;根据图示可知,该反应的微观本质是钡离子与硫酸根离子结合生成硫酸钡沉淀,铜离子与氢氧根离子结合生成物氢氧化铜沉淀;反应结束,硫酸铜过量,溶液中可自由移动的离子数目增多,所以M点过后溶液导电率升高;镁与氧气反应生成氧化镁的过程中镁元素的化合由0价变为+2价,氧元素的化合价由0价变为-2价,化合价发生改变,属于氧化还原反应;镁和硫酸铜反应生成硫酸镁和铜的过程中,镁元素的化合由0价变为+2价,铜元素的化合价由+2价变为0价,化合价发生改变,属于氧化还原反应;氢氧化钡与硫酸铜反应生成硫酸钡与氢氧化铜的过程中,所有元素的化合价没有发生改变,不属于氧化还原反应。故填:甲和乙。