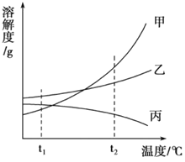
题目内容
【题目】太阳能汽车利用太阳能来驱动,真正实现了零排放,有效地减少了对环境的污染,其产业的发展日益蓬勃。从某种意义上讲,太阳能汽车也是电动汽车的—种,所不同的是电动汽车的蓄电池靠工业电网充电,而太阳能汽车用的是太阳能电池。
(1)该太阳能汽车在白天给蓄电池充电的同时行驶,该行驶过程中首先_____能转化为化学能,然后转化为_____能,最终转化为机械能。
(2)该汽车车体主体材料是一种密度小、且抗腐蚀性好的一种合金,你认为下列材料中最合适的是_____(填字母)
A 玻璃钢 B 锰钢 C 硬铝 D 生铁
(3)目前还有一种新能源汽车,氢燃料电池汽车,该种汽车的储氢材料是循环吸放氢过程中生成新的氢化物,其中一种为氢化铝锂(LiAlH4)的氢化物,在125℃ 时分解为氢气和一种金属单质及氢化锂(LiH)。请你写出氢化铝锂分解反应的化学方程式①_____。反应前后铝元素的化合价分别为②_____。生活中使用的干电池中含有铅、镉、汞等,如果将废旧电池随意丢弃会③_____,威胁④_____。
【答案】光 电 C 2LiAlH4![]() 2Al+2LiH+3H2↑ +3、0 造成水体和土壤污染 人类健康
2Al+2LiH+3H2↑ +3、0 造成水体和土壤污染 人类健康
【解析】
(1)该太阳能汽车在白天给蓄电池充电的同时行驶,该行驶过程中首先光能转化为化学能,然后转化为电能,最终转化为机械能。故填:光;电;
(2)硬铝是一种密度小、且抗腐蚀性好的一种合金;故选:C;
(3)氢化铝锂(LiAlH4)在125℃时氢化铝锂分解为氢气、金属铝及氢化锂(LiH),反应方程式为:2LiAlH4![]() 2Al+2LiH+3H2↑;反应前LiAlH4中铝元素的化合价为+3价,反应后金属铝的化合价为0;生活中使用的干电池中含有铅、镉、汞等,如果将废旧电池随意丢弃会造成水体和土壤污染,威胁人类健康。故填:2LiAlH4
2Al+2LiH+3H2↑;反应前LiAlH4中铝元素的化合价为+3价,反应后金属铝的化合价为0;生活中使用的干电池中含有铅、镉、汞等,如果将废旧电池随意丢弃会造成水体和土壤污染,威胁人类健康。故填:2LiAlH4![]() 2Al+2LiH+3H2↑;+3、0;造成水体和土壤污染;人类健康。
2Al+2LiH+3H2↑;+3、0;造成水体和土壤污染;人类健康。

【题目】化学课堂围绕“酸碱中和反应”,将学生分成若干小组探究。请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是:_________,该反应的化学反应基本类型是_____。
(查阅资料)CaCl2溶液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想 I:只有 CaCl2 猜想 II:有_____
猜想 III:有 CaCl2 和 Ca(OH)2 猜想 IV:有 CaCl2、HCl 和 Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想 IV 不合理,其理由是_____。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
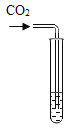
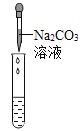
实验方案 | 滴加紫色石蕊溶液 | 通入 CO2 | 滴加 Na2CO3 溶液 |
实验操作 |
|
|
|
实验现象 | ______ | _____ | 产生白色沉淀 |
实验结论 | 溶液中含有:Ca(OH)2 | 溶液中含有:Ca(OH)2 | 溶液中含有:Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想 III 是正确的。
(评价反思)
(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_____。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_____