题目内容
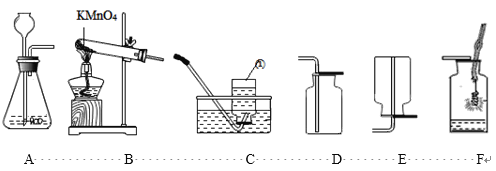
【题目】如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题:
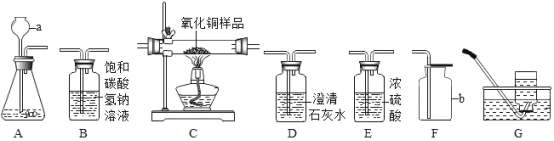
(1)仪器a的名称是___,仪器b的名称是___。
(2)实验室可以用装置A来制取二氧化碳,装置A中发生反应的化学方程式为___。若检验生成的气体是二氧化碳,则应将气体通入___(填序号)装置的溶液中。
(3)若以石灰石和稀盐酸为原料,制取的气体中常含有少量的HCl气体和水蒸气。小雪欲制取干燥、纯净的CO2气体,装置连接顺序是 A→B→___→F(填写仪器序号字母)。
(4)装置A还可以用来制取氢气,请写出用锌和稀硫酸反应制取氢气的化学方程式___。
(5)若小雪同学欲利用制备的纯净氢气来测定某氧化铜样品中CuO的质量分数(杂质不反应),取5g该样品,仪器的连接顺序为A→E1→C→E2→E3(已知:CuO+H2 ![]() Cu+H2O)。 一段时间后小明同学测得反应前后E2装置质量增加了0.9g,计算该样品中CuO的质量分数为___%(精确到0.1%)。如果装置没有连接E1,则测量结果将___(填“偏小”“偏大”或“基本不变”)。
Cu+H2O)。 一段时间后小明同学测得反应前后E2装置质量增加了0.9g,计算该样品中CuO的质量分数为___%(精确到0.1%)。如果装置没有连接E1,则测量结果将___(填“偏小”“偏大”或“基本不变”)。
【答案】长颈漏斗 集气瓶 CaCO3+2HCl=CaCl2+H2O+CO2↑ D E Zn+H2SO4=ZnSO4+H2↑ 80.0 偏大
【解析】
(1)仪器a是长颈漏斗、b是集气瓶;
(2)实验室中制取二氧化碳的原理是碳酸钙与盐酸反应生成氯化钙、水和二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳能使澄清的石灰水变浑浊,所以常用澄清的石灰水检验二氧化碳气体;
故填:D;
(3)为了得到干燥纯净的二氧化碳应该先用碳酸氢钠溶液来吸收氯化氢,然后再用浓硫酸来干燥,因此仪器的连接顺序为:A→B→E→F;
(4)锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式:Zn+H2SO4=ZnSO4+H2↑;
(5)解:E2装置质量增加的质量即为氢气还原氧化铜生成的水的质量0.9g,
设:氧化铜的质量为x,
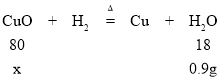
80:18=x:0.9g
x=4g
该样品中CuO的质量分数为4g÷5g×100%=80.0%
如果装置没有连接E1,氢气中混有的水蒸气也会被E2装置中的浓硫酸吸收,测定水的质量偏大,则测量结果将偏大。