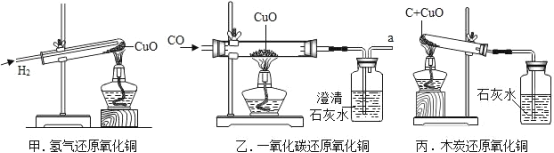
题目内容
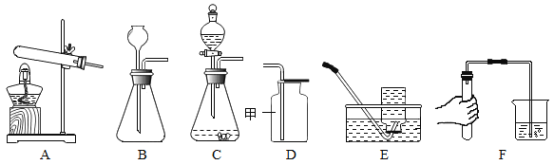
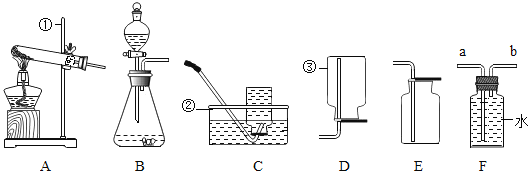
【题目】合成氨人类科学技术上的一项重大突破,为化肥工业奠定了基础,以下是合成氨的工艺流程图。
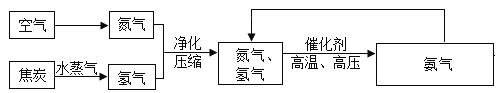
资料:常温下,氮气沸点是-196°C,氧气沸点是-183°C。
(1)工业上用分离液态空气的方法制取氮气,根据空气中液氧和液氮的沸点不同,将液态空气升温,先逸出的物质主要是________________________________(填化学式),此过程属于_______________________________变化(填“物理”或“化学”)。
(2)写出合成氨气的化学方程式_______________________________。
【答案】N2 物理 
【解析】
(1)工业上用分离液态空气的方法制取氮气主要是利用氮气和氧气的沸点不同,将液态空气升温,由于氮气沸点更低,所以最先逸出的物质主要是氮气(N2),该过程中没有新物质生成,属于物理变化;
(2)氮气和氢气在高温高压、催化剂的条件下生成氨气,方程式为: 。
。
故答案为:N2,物理, 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某探究小组的同学用H2SO4、Ba(NO3)2、NaOH、K2CO3四种溶液进行“复分解反应发生条件”及应用的实验探究。
(1)将四种溶液两两混合,其中用H2SO4与另三种溶液分别混合的现象如下:
Ba(NO3)2 | NaOH | K2CO3 | |
H2SO4 | 白色沉淀 | 无明显现象 | 产生气体 |
①由于有白色沉淀生成,H2SO4与Ba(NO3)2发生了反应,反应的化学方式为 。
②实验中的H2SO4与NaOH混合“无明显现象”实际上发生了化学反应,其反应过程如图所示,反应的实质是H+和OH—结合生成H2O。同理H2SO4与K2CO3发生反应的实质是 。
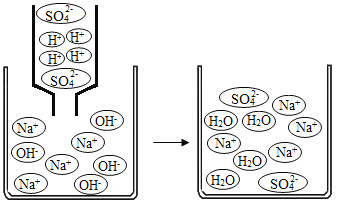
由此同学们总结得出:复分解反应发生的条件是有沉淀或气体或水生成。
(2)若某复分解反应的生成物中有NaCl,则该反应的反应物是 (写出两组)。
(3)若将原四种溶液混合反应后过滤,其滤液经检验:溶液呈碱性且不含Ba2+、SO42—。滤液中除可以肯定存在的离子外,设计实验证明还可能存在的离子 。