题目内容
【题目】工业上用甲和乙反应制备丙和丁,其反应的微观示意图如下:
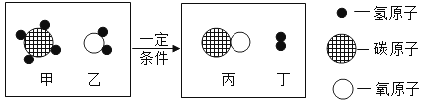
(1)该化学变化中没有发生改变的粒子是________(填“分子”或“原子”)。
(2)写出该反应的化学方程式_______________________________。
(3)反应前后化合价可发生变化的元素是__________(填元素符号)。
(4)参加反应的甲,乙的质量比是____________。
【答案】原子 CH4+ H2O CO+3H2 C、H 8:9
CO+3H2 C、H 8:9
【解析】
(1)化学变化中原子的质量、种类、个数都不变。故填原子。
(2)由图可知,反应物是甲烷和二氧化碳,生成物是一氧化碳和氢气,配平得方程式为:CH4+ H2O CO+3H2.
CO+3H2.
(3)在CH4、CO中碳元素的化合价分别为-4、+2,在CH4、H2O、H2中氢元素的化合价分别为+1、+1、0,所以反应前后化合价发生可变化的元素是C、H.
(4) 故参加反应的甲,乙的质量比是16::18=8:9.
故参加反应的甲,乙的质量比是16::18=8:9.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目