题目内容
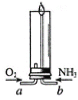
【题目】铜是一种不活泼的金属,但长期露置在潮湿的空气中会锈蚀生成“铜绿”[化学式:Cu2(OH)2CO3]。某科研小组为探究铜绿生成的条件,并从已部分锈蚀的废铜屑中回收铜(假设不含其它杂质),实验设计如下:
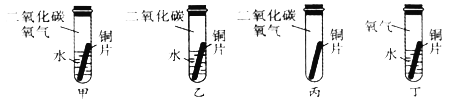
(1)证明生成铜绿的条件除存在O2和H2O外,还必须有CO2。为“证明必须有CO2”需要进行以上实验中的_____(填实验编号)。
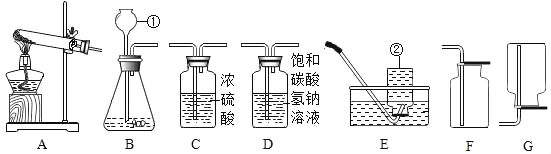
(2)利用已部分锈蚀的废钢屑按照以下实验方案回收铜。
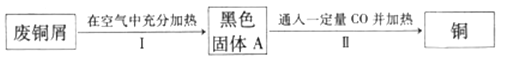
①已知铜绿受热分解为固体A、CO2和H2O,则步骤I中发生的反应类有_____。
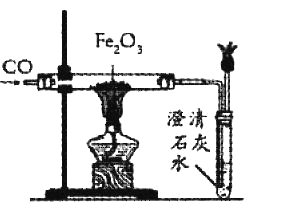
②步骤Ⅱ中主要发生的化学反应方程式为_____。
③若步骤Ⅱ所得钢中含有少量Cu2O,你认为可能的原因是_____(写一条即可)。
④若用CO还原16.0gCuO得到Cu和Cu2O混合物的质量为ag,则a的取值范围为_____。
【答案】甲和丁 分解反应、化合反应 CO + CuO![]() Cu + CO2 反应温度不够高 12.8g<a<14.4g
Cu + CO2 反应温度不够高 12.8g<a<14.4g
【解析】
(1)证明生成铜绿的条件除存在O2和H2O外,还必须有CO2。为“证明必须有CO2”需要进行实验甲和丁,即控制变量二氧化碳。
(2)①铜绿受热分解为固体A、CO2和H2O属于分解反应,铜和空气中的氧气加热生成氧化铜是化合反应,则步骤I中发生的反应类型有分解反应、化合反应。
②步骤Ⅱ中主要发生的化学反应方程式为CO + CuO![]() Cu + CO2。
Cu + CO2。
③若步骤Ⅱ所得铜中含有少量Cu2O,可能的原因是反应温度不够高。
④若用CO还原16.0gCuO得到Cu和Cu2O混合物的质量为ag,则a的取值范围为
设得到全部为铜的质量为x

x=12.8g
设得到全部为氧化亚铜的质量为y
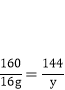
y=14.4g
故12.8g<a<14.4g。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】某同学利用自制的紫色紫薯汁进行“溶液酸碱性检验”的探究实验,实验现象记录如下。
溶液 | 白醋 | 盐酸 | 蔗糖水 | 肥皂水 | 石灰水 |
加入紫薯汁后溶液的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
下列结论或推论错误的是( )
A. 蔗糖水呈中性
B. 溶液的pH:肥皂水![]() 蔗糖水
蔗糖水![]() 白醋
白醋
C. 将等体积的盐酸与石灰水混合,溶液pH一定等于7
D. 将等体积的白醋与盐酸混合,溶液pH一定小于7