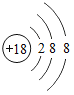
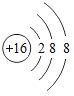
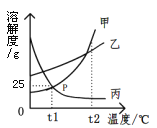
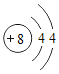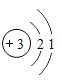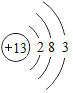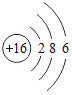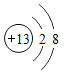题目内容
【题目】已知某溶液A中的溶质可能含有HCl、BaCl2、Ba(OH)2中的一种或多种,另有一固体样品B可能含NH4Cl、CaCl2、NaOH、MgCl2中的一种或多种,按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
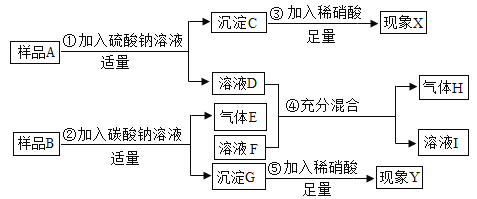
试根据实验过程和发生的现象,填写以下空白:
(1)气体H的化学式为________________。
(2)样品A中一定存在的物质是___________。.
(3)现象y为___________。
(4)溶液D中,一定存在的阳离子是___________(填写离子符号)。
(5)写出步骤②中发生反应的化学方程_________________。
(6)溶液F中,一定存在的酸根离子是_______________(填写离子符号)。
(7)固体样品B中,一定不存在的物质是____(填写化学式),得出此结论的理由是_____。
【答案】CO2 HCl、BaCl2 沉淀溶解 Na+、H+ MgCl2+2NaOH=2NaCl+Mg(OH)2↓、NH4Cl+NaOH=NaCl+H2O+NH3↑ CO32、Cl- CaCl2 若样品B中含有氯化钙则加入碳酸钠,碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,溶液F和溶液D混合不会产生气体
【解析】
硫酸根离子和钡离子生成不溶于酸的硫酸钡沉淀,氢离子和氢氧根离子反应会生成水,氢氧根离子和铵根离子反应会生成氨气,碳酸钠和钙离子反应生成溶于酸的碳酸钙沉淀,碳酸根离子和镁离子反应生成溶于酸的碳酸镁沉淀,
溶液A加入硫酸钠产生沉淀,所以含有氯化钡或是氢氧化钡,产生的沉淀是硫酸钡,溶液D中含有氢氧化钠或氯化钠或盐酸;样品B中加入碳酸钠溶液,产生了气体E,氢氧化钠能与氯化铵反应产生氨气,所以E是氨气,B中一定含有氯化铵和氢氧化钠,同时生成了氯化钠,溶液F中含有碳酸钠、氯化钠;产生了沉淀G,碳酸钠能与氯化钙反应产生沉淀碳酸钙和氯化钠,则D和F混合就不会产生气体,所以D中含有氯化氢,F中含有碳酸钠;由于氢氧化钠能与氯化镁反应产生氢氧化镁沉淀,所以B中一定没有氯化钙,可能有氯化镁、氢氧化钠和氯化氨,氢氧化钠和氯化镁反应会生成氢氧化镁沉淀,所以现象Y是沉淀溶解。
(1)由分析可知气体H的化学式为CO2;
(2)溶液D和F会生成气体,所以溶液D中一定含有氢离子,所以样品A中一定存在的物质是HCl、BaCl2;
(3)氢氧化镁沉淀和酸反应会生成可溶性镁盐,所以现象Y为:沉淀溶解;
(4)溶液D中,一定存在的阳离子是Na+、H+;
(5)步骤②中发生的反应是氯化铵和氢氧化钠反应生成氯化钠、水和氨气,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,化学方程式分别为:NH4Cl+NaOH=NaCl+H2O+NH3↑、MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(6)溶液F中,一定存在的酸根离子是:CO32、Cl-;
(7)固体样品B中,一定不存在的物质是:CaCl2,得出此结论的理由是:若样品B中含有氯化钙则加入碳酸钠,碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,溶液F和溶液D混合不会产生气体。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】某化学小组为了探究一瓶久置在空气中的氢氧化钠样品(不含有水分)的变质程度,进行了如下实验:取该氢氧化钠样品133g于烧杯中加水完全溶解然后向烧杯中逐渐加入一定溶质质量分数的氯化钡溶液,反应过程中对加入氯化钡溶液的质量与烧杯中产生沉淀的质量进行了记录,部分数据见表。
加入氯化钡溶液的质量/g | 20 | 40 | 80 |
生成沉淀的质量/g | 1.97 | 3.94 | 5.91 |
试分析计算:
(1)13.3g氢氧化钠样品中碳酸钠的质量_______;
(2)13.3g氢氧化钠样品变质前的质量_______
【题目】同学们整理实验室时,发现一瓶敞口放置且失去标签的白色粉末状药品,老师告诉大家原瓶药品可能是碳酸钠、碳酸钙、氢氧化钠中的一种。同学们对此很好奇,于是他们对这瓶白色粉末的成分做了如下探究:
(实验Ⅰ)小明取一定量白色粉末于烧杯中,加水搅拌,充分溶解后,过滤,得到固体和无色溶液。
(实验Ⅱ)小明取实验I得到的固体于试管中,滴加足量稀盐酸后,观察到有气泡产生,于是小明马上就得出结论,该瓶中白色粉末一定是碳酸钙,但是小军却认为小明的结论不一定正确,固体还可能是碳酸钠,小军的理由是碳酸钠溶于水形成_____(填“饱和”或“不饱和”)溶液后,也会有固体剩余。请写出碳酸钠与盐酸反应生成气体的化学方程式:_____。
(实验Ⅲ)小明和小军认为有必要再对实验I中滤液的成分进行探究,过程如下:
实验步骤 | 实验现象 | 实验结论 |
(1)取少量滤液于试管中,向其中滴加2~3滴无色酚酞溶液,振荡 | 溶液由无色变为红色 | 该瓶中白色粉末一定不是_____ |
(2)另取少量滤液于试管中,滴加过量氯化钙溶液,振荡,静置 | _____ | 该瓶中白色粉末一定有碳酸钠 |
(反思与交流)实验结束后,同学们通过讨论,一致认为原试剂瓶中的药品也可能不是碳酸钠,你认为他们的理由是_____(用化学方程式表示)。
【题目】有一包白色粉末,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() ,为确定该白色粉末的成分,同学们进行了有关实验,实验流程和现象如下:
,为确定该白色粉末的成分,同学们进行了有关实验,实验流程和现象如下:
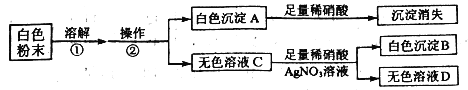
请回答以下问题。
(1)操作②的名称是________,①中发生反应的化学方程式是________。
(2)通过以上实验可知,此白色粉末中一定含有_____;一定不含_____;判断的理由是______。
(3)同学们利用下列两种方案继续对溶液D的成分进行检验,请选择一种方案进行回答。
方案一 | 方案二 | |
操作 | 取少量溶液D,向其中滴加紫色石蕊溶液,观察到溶液变为红色。 | 取少量溶液D,向其中滴加氯化钠溶液,无明显现象;再滴加碳酸钠溶液,观察到先有气泡产生,后产生白色沉淀。 |
结论 | D中所含阳离子一定有上________。 | D中所含阳离子一定有________。 |