题目内容
【题目】氢气燃烧能放出大量的热,且生成物只有水,“氢能”将是未来最理想的新能源,氢气的制备和储存成为研究的热点。
(1)最理想的制氢方法:在合适的催化剂作用下,利用太阳光使水分解。该制氢过程__(选填“吸收”或“放出”)能量,生成的氢气与氧气在相同条件下的体积之比为_______。
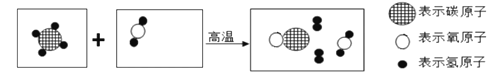
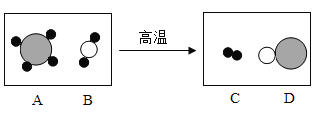
(2)下图是工业上制备氢气的微观示意图,其中不同的球代表不同的原子,则氢分子是___(填字母),该反应中A、D两物质的分子个数比是_____。
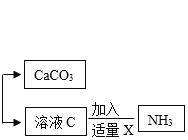
(3)某化学家根据“原子经济”的思想设计制备氢气的反应步骤如下图:
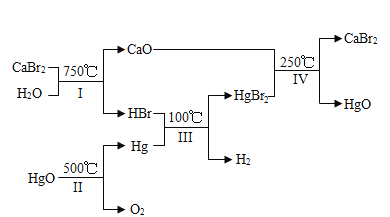
①图中Ⅳ反应属于复分解反应,写出该反应的化学方程式:_____。
②在整个流程中,可循环利用的物质有_______。
(4)我国稀土资源丰富,某种稀土储氢材料(用M表示)的储氢原理可表示为![]() 。 M的化学式为_______。
。 M的化学式为_______。
【答案】吸收 2: 1 C 1:1 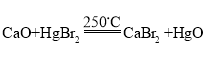 HgO和CaBr2 LaNi5
HgO和CaBr2 LaNi5
【解析】
(1)利用太阳光使水分解时,消耗的光能贮存在生成的氢气中,所以利用太阳光使水分解得到氢气的反应是一个吸收能量的过程,故填吸收;
由电解水的实验可知,分解水后生成的氢气与氧气在相同条件下的体积之比为2:1,故填2:1。
(2)1个氢分子是由2个氢原子构成的,所以图中表示氢分子的是C,故填C;
化学反应前后各元素的原子数目不变,所以该反应的化学方程式可以表示为A+B![]() 3C+D,z则该反应中A、D两物质的分子个数比是1:1,故填1:1。
3C+D,z则该反应中A、D两物质的分子个数比是1:1,故填1:1。
(3)①由图可知,反应IV是氧化钙与溴化汞在250° C时反应生成溴化钙和氧化汞,故反应的化学方程式写为:CaO+HgBr2![]() CaBr2+HgO;
CaBr2+HgO;
②由流程图可知,开始时参加反应的CaBr2和HgO在流程的最后又重新生成,所以CaBr2和HgO在流程中可以循环使用,故填CaBr2和HgO。
(4)由反应的原理可知,反应前只出现了6个H原子,反应后出现了1个La原子、5个Ni原子和6个H原子,根据质量守恒定律的原因可知,尚缺的1个La原子和5个Ni原子存在于M中,所以M的化学式写为LaNi5,故填LaNi5。