题目内容
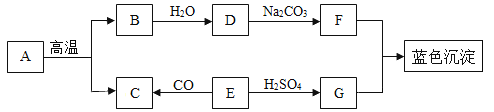
【题目】如下图A、B、C、D、E、F分别表示初中常见的物质,物质之间的各种关系如图所示(部分反应及转化关系有所省略)。物质A、B、C含阳离子种类相同;E、F阴离子种类相同;B为重要的化工原料,F溶液为具有挥发性的酸溶液。

(1)写出相应化学式:B_______,C________,D________。
(2)写出E、F相互转化的化学方程式_________。
(3)写出A溶液与E溶液反应的实验现象________。
【答案】NaOH Na2CO3 Ba(OH)2 ![]() ,
,![]() 产生白色沉淀
产生白色沉淀
【解析】
A、B、C、D、E、F分别表示初中常见的物质,F溶液为具有挥发性的酸溶液,可推出F为盐酸,E、F阴离子种类相同,且E可与盐酸相互转化,可推出E为氯化钡,A可与氯化钡反应,可推出A为可溶性碳酸盐或可溶性硫酸盐,B是一种重要的化工原料,且B可与A互相转化,可推出B为氢氧化钠,A、B、C含阳离子种类相同,且C可与盐酸反应,可推出C为碳酸钠,则A为硫酸钠,D可转化为氢氧化钠和氯化钡,且D可以硫酸钠、碳酸钠、盐酸反应,可推出D为氢氧化钡。
(1)B为氢氧化钠,化学式为:NaOH,C为碳酸钠,化学式为:Na2CO3,D为氢氧化钡,化学式为:Ba(OH)2;
E为氯化钡,F为盐酸,氯化钡可以稀硫酸反应生成盐酸,该反应的化学方程式为:![]() ;盐酸可以氢氧化钡反应生成氯化钡和水,该反应的化学方程式为:
;盐酸可以氢氧化钡反应生成氯化钡和水,该反应的化学方程式为:![]() ;
;
(2)A为硫酸钠,E为氯化钡,硫酸钠与氯化钡反应会生成硫酸钡白色沉淀和氯化钠,故实验现象为:产生白色沉淀。

【题目】根据下表回答问题。
温度/℃ | 20 | 40 | 50 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)20℃时,溶解度最大的物质是__________
(2)50℃时,在100g水中放入36g氯化钠充分溶解持温度降到40℃,得到的是氯化钠的溶液__________(选填“饱和”或“不饱和”):
(3)现将100gKNO3和38gNaCl同时放入一个盛有100克80℃水的烧杯中,然后降温至20℃,得到的溶液中,KNO3的溶质质量分数的计算式为__________。
【题目】酸、碱、盐是九年级化学学习的重要知识,并且它们具有广泛的用途。
(1)下列关于酸、碱、盐的说法正确的是________________。
A 酸与金属都能反应生成盐和氢气 B 能够生成盐和水的反应都叫做中和反应
C 酸和碱都含有氢元素 D 酸、碱、盐之间都能发生复分解反应
(2)酸和碱之间能够发生中和反应,康康向滴有酚酞的氢氧化钠溶液中逐滴加入稀盐酸,该反应的化学方程式为________________;若滴加一定量稀盐酸后溶液变为无色,测得反应后溶液的 pH=6,则溶液中存在的阳离子为________________ (填离子符号)。
(3)某白色固体中可能含有碳酸钠、硝酸钡、氢氧化钠、硫酸铜中的一种或几种,为确定该固 体成分,现进行以下实验:
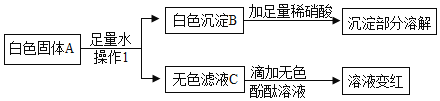
①根据上述实验分析,A 中一定含有的物质是________________,C 中一定含有的溶质是
________________。
②为进一步确定固体 A 中可能存在的物质,对滤液 C 进行实验,完成下表。
实验操作 | 现象 | 结论 |
________________ | ________________ | A中有氢氧化钠 |
(4)将 50 g 稀盐酸加入 50 g 氢氧化钠溶液中恰好完全反应,所得溶液中溶质的质量分数 为 5.85%。试计算氢氧化钠溶液中溶质的质量分数。________________