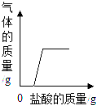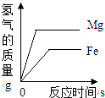题目内容
【题目】下列四个图像反映了对应实验过程中相关量的变化,其中不正确的是( )
|
|
|
|
A.在部分变质的NaOH溶液中滴加稀盐酸 | B.O2溶解度受温度影响的变化曲线 | C.等质量的镁粉和铁粉与足量同浓度的稀盐酸反应 | D.硫酸溶液稀释过程中pH的变化 曲线 |
【答案】B
【解析】在部分变质的NaOH溶液中滴加稀盐酸,稀盐酸首先与NaOH发生中和反应,当NaOH被消耗完时,滴入的稀盐酸再与Na2CO3反应生成气体,随着稀盐酸的加入,生成气体的质量逐渐增加,当Na2CO3反应完时,气体质量就不再增加了,A正确;氧气的溶解度随温度升高而减小,B错;等质量的镁粉和铁粉与足量同浓度的稀盐酸反应,Mg的反应速率比Fe快,且最终Mg生成氢气的质量比Fe的多,C正确;硫酸显酸性,随着水的加入,酸性逐渐减弱.溶液的pH逐渐增大至接近于7,D正确.

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是
物 质 | 选用试剂 (过量) | 操作方法 | |
A | CO2 (CO) | O2 | 点燃 |
B | Zn (Cu) | 稀硫酸 | 加入稀硫酸充分反应后过滤、洗涤干燥 |
C | CaCO3 (NaCl) | 水 | 加入水中一定时间后过滤、洗涤干燥 |
D | CO (CO2) | 氧化铜 | 通过装有灼热氧化铜的玻璃管 |
【题目】(8分)在化学实验探究课上,化学老师交给化学兴趣小组一包可能含有Na2SO4、NaNO2(亚硝酸钠)、NaCl(至少含有两种物质)的白色粉末,请你和同学们一起参与探究该白色粉末的主要成分。
(1)提出问题:该白色粉末的主要成分是什么?
(2)查阅资料:

(3)提出猜想:猜想Ⅰ:只含有NaCl、Na2SO4
猜想Ⅱ:只含有NaCl、NaNO2
猜想Ⅲ:只含有
猜想Ⅳ:含有NaCl、Na2SO4、NaNO2
(4)进行探究
步骤 | 实验操作 | 实验现象 | 结论 |
一 | 取少量固体样品于两支试管中,加蒸馏水溶解,向试管1滴入无色酚酞溶液,向试管2滴入过量的氯化钡溶液。 | 试管1:溶液变红色 试管2:无明显现象 | 一定有 , 一定没有 。 |
二 | 另取适量固体样品于试管中,加蒸馏水溶解,滴加硝酸 银溶液 | 有白色沉淀产生 | 一定有 。 |
(5)通过实验,猜想 成立。
(6)写出步骤二中发生的化学方程式 。
(7)拓展:粗盐中常含有可溶性和不溶性杂质,粗盐提纯的基本操作步骤是溶解、 、蒸发。