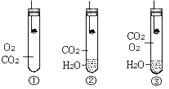
题目内容
【题目】除去下列各组物质中的少量杂质,所用方法不正确的是:
选项 | 物质 | 杂质 | 除去杂质的方法 |
A | NaCl | Na2CO3 | 加入足量的稀盐酸不再有气体产生,蒸发 |
B | N2 | O2 | 通过红热的铜丝 |
C | KNO3溶液 | Ba(NO3)2 | 滴加适量K2SO4溶液、过滤 |
D | Ca(OH)2 | CaCO3 | 滴入足量稀盐酸至不再产生气体 |
A. A B. B C. C D. D
【答案】D
【解析】除去杂质的原则是所加试剂只与杂质反应,且不生成新的杂质。A、Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,加入足量的稀盐酸不再有气体产生,蒸发,得到氯化钠固体,正确;B、2Cu+O2![]() 2CuO,铜不与氮气反应,正确;C、K2SO4 + Ba(NO3)2 ==BaSO4↓+ 2KNO3 ,滴加适量K2SO4溶液、过滤,得到KNO3溶液,正确;D、CaCO3 + 2HCl == CaCl2 + H2O + CO2↑,有CaCl2生成,引入了杂质,错误。故选D。
2CuO,铜不与氮气反应,正确;C、K2SO4 + Ba(NO3)2 ==BaSO4↓+ 2KNO3 ,滴加适量K2SO4溶液、过滤,得到KNO3溶液,正确;D、CaCO3 + 2HCl == CaCl2 + H2O + CO2↑,有CaCl2生成,引入了杂质,错误。故选D。

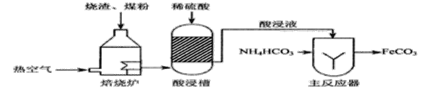
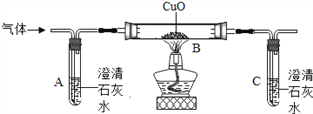
【题目】某化学兴趣小组在探究盐酸的化学性质,做了如下实验:
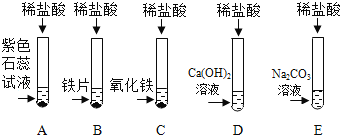
(1)试管A中的现象是________,反应后试管B中一定有的阳离子是______(写离子符号)。
(2)试管C中反应的化学方程式为___________。
(3)实验结束后,小组同学将D、E两支试管中的废液同时倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:NaCl; 乙同学猜想:NaCl、CaCl2;丙同学猜想:NaCl、CaCl2、HCl;
丁同学的猜想:NaCl和Na2CO3。
【查阅资料】NaCl、CaCl2溶液均呈中性
【交流讨论】甲同学认为丙同学的猜想一定不正确。理由是____________。
【设计实验】乙、丁两位同学分别设计如下实验验证自己的猜想:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
乙 | 取少量滤液于试管中,向其中滴加无色酚酞试液 | 无明显现象 | 猜想正确 |
丁 | 取少量滤液于试管中,向其中滴加稀盐酸 | ______ | 猜想正确 |
【反思评价】实验结束后,甲同学认为_____(填“乙”或“丁”)同学的实验结论错误,原因是_____________。
【题目】下图是某食盐包装上的部分说明。食盐中加入碘酸钾的目的是补充微量元素___________。

【提出问题】为什么在汤、菜即将煮好时再加入碘盐才能确保碘效?
【查阅资料】碘酸钾的化学式是KIO3,是一种白色粉末,熔点560℃。采用热重分析仪对碘酸钾加热过程展开研究,混合物中碘酸钾的的质量分数(纵坐标)随温度(横坐标)变化的曲线如图10所示。
【猜想假设1】KIO3与KClO3性质类似,受热分解产生O2。
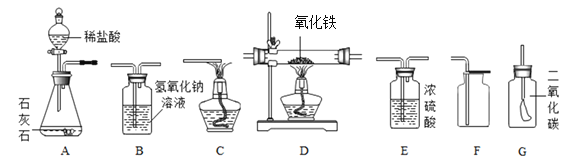
【实验探究1】研究小组进行如图11所示实验,宜选用装置___________进行。验证KIO3分解产生氧气的操作和现象为_________________________。
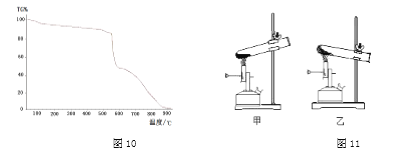
【得出结论1】KIO3受热同时生成碘化钾(KI),反应方程式为_____________________。
【提出新问题】为什么生成KI就会降低碘效?
【查阅资料2】KIO3在人体内转化为I-而被吸收。KI是白色固体,在空气中与O2、CO2、H2O中的两种或三种物质反应生成单质I2而泛黄变质。
【实验探究2】研究小组开展以下实验。
操 作 | 现 象 | 结 论 |
如下图所示,在燃烧匙中放入KI固体,然后分别放置在① ② ③号试管中,数日后观察现象。
| _________ | KI固体在空气中与O2、CO2、H2O共同作用而变质导致碘效降低。 |
【反思提高】
⑴ 讨论后大家认为以上实验方案有所欠缺。甲同学做了补充实验:_____________,数日后观察无明显现象,证明以上结论正确。
⑵ 乙同学推测另一种产物是碳酸盐,请用实验加以证明:______________,证明推测正确。
【拓展应用】生活中鉴别真假加碘盐的方法是:取少量碘盐样品在干净的锅里高温爆炒2分钟,再加入部分未爆炒过的碘盐在碗中混合,加少量白醋,再把刚切好的土豆片浸泡其中,20分钟后若溶液变蓝,则是加碘盐。下列说法不正确的是(_________)
A.实验中土豆片不可用其它食品代替
B.直接将加碘盐放在土豆片上不能呈现蓝色
C.可能是酸性条件下KIO3和KI能反应生成I2
D.烹饪时加醋可能增大食盐中的碘流失