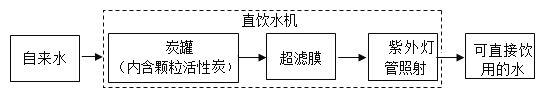
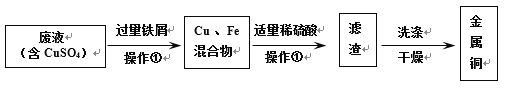
题目内容
【题目】A、B、C、D、E、F、G、H八种物质,有下图所示关系,“→”表示可以向箭头所指方向转化,通常情况下A是一种暗紫色固体,F是一种无色液体,G是一种常见的银白色金属,在②的反应前后B的质量和化学性质都不改变。
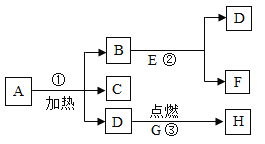
试推断:
(1)写出反应③的实验现象_________________。
(2)写出反应①、②、③的化学式表达式:①_________,②_________, ③__________。
(3)上述反应中属于化合反应的是__________ (填序号)。
【答案】剧烈燃烧,火星四射,生成黑色的固体 KMnO4![]() K2MnO4+MnO2+O2 H2O2
K2MnO4+MnO2+O2 H2O2 ![]() H2O+O2 Fe+O2
H2O+O2 Fe+O2![]() Fe3O4 ③
Fe3O4 ③
【解析】
通常情况下A是一种暗紫色固体,A可能是高锰酸钾。B能与E接触生成D与F,F是一种无色液体,故B是二氧化锰,D是氧气,F是水,E 是过氧化氢,经推断合理。
(1)反应3是铁在氧气中燃烧,现象是剧烈燃烧,火星四射,生成黑色的固体。
(2)①该反应是高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,反应的表达式为:KMnO4![]() K2MnO4+MnO2+O2
K2MnO4+MnO2+O2
②该反应是过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,反应的符号表达式为:H2O2 ![]() H2O+O2
H2O+O2
③该反应是铁与氧气在点燃的条件下反应生成四氧化三铁,反应的符号表达式为:Fe+O2![]() Fe3O4
Fe3O4
(3)反应①②是一变多的反应,是分解反应,反应③是多变一的反应是化合反应。故选③.

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】文文想通过实验测定稀硫酸中硫酸的质量分数,他分四次向182.5g稀硫酸(包含硫酸和水)中加入含有杂质的锌粉(杂质不溶于盐酸也不与盐酸发生反应),记录所加锌粉质量与产生氢气的质量如图。
次数 | 1 | 2 | 3 | 4 |
锌粉质量/g | 5 | 5 | 5 | 5 |
氢气质量/g | M | 0.15 | 0.1 | 0 |
(1)M的数值为.________ 。
(2)请计算稀硫酸中硫酸所占的质量分数_______。
(3)含杂质的锌中锌的质量分数_______。
【题目】用化学用语表示:
(1)2个硫原子____; (2)3个氮气分子____;
(3)4个铵根离子____; (4)五氧化二磷____;
(5)氦气 ____; (6)二氧化硫中硫元素显+4价____。
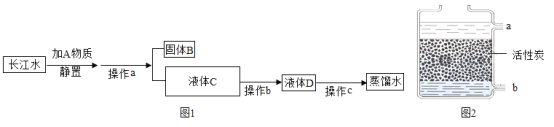
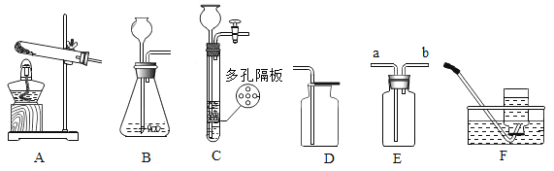
【题目】(一)小明在实验室观察完品红扩散实验后,想把变红的水做一个简单的处理后再排入下水道。请根据如图相关信息,回答下列问题:
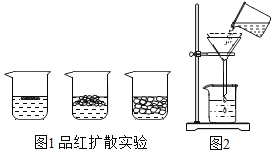
(1)图2过滤操作中必须用到的玻璃仪器分别是______、______、烧杯,请指出该操作过程中的其中两处错误______、______。
(2)小明同学将红色液体按过滤的正确操作完成后,发现过滤后的液体中仍有少量品红固体,则造成这种情况可能的原因是(填一种即可)______
(3)水是一种重要的资源,人类离不开水。在很长一段时期内,人类不了解水到底是由什么组成的。直到18世纪末,人类通过电解水实验才最终认识了水的组成。下列实验也能证明水是由氧元素和氢元素组成的是______(填序号)
A 氢气在氧气中燃烧 B 石蜡在空气中燃烧 C 水的蒸发 D 水的净化
(二)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:______。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行试验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比l:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验______形成对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是______。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和______;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证______。