题目内容
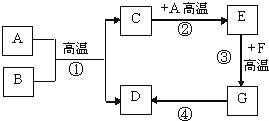
【题目】小红对暗紫色粉末A进行实验,实验过程如图所示。请回答下列问题
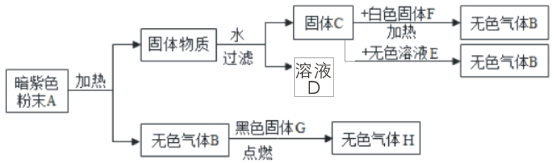
(1)写出下列物质的化学符号:A_____,E_____,F_____,G_____。
(2)写出A受热分解的化学符号表达式:_____;
(3)黑色固体G在无色气体B中得到H的化学符号表达式:_____,检验气体H的方法是_____。
【答案】KMnO4 H2O2 KClO3 C 2KMnO4![]() K2MnO4+MnO2+O2↑ C+O2
K2MnO4+MnO2+O2↑ C+O2![]() CO2 将气体通入澄清石灰水中,澄清石灰水变浑浊
CO2 将气体通入澄清石灰水中,澄清石灰水变浑浊
【解析】
根据暗紫色的粉末A加热生成无色气体B,B和黑色固体G点燃生成无色气体H,所以B是氧气,G是碳,H是二氧化碳,A是高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,所以C是二氧化锰,二氧化锰和E、F都会生成氧气,所以F是氯酸钾,E是过氧化氢溶液,然后将推出的物质进行验证即可。
(1)暗紫色的粉末A加热生成无色气体B,B和黑色固体G点燃生成无色气体H,所以B是氧气,G是碳,H是二氧化碳,A是高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,所以C是二氧化锰,二氧化锰和E、F都会生成氧气,所以F是氯酸钾,E是过氧化氢溶液,经过验证,推导正确,所以A是KMnO4,E是H2O2,F是KClO3,G是C;
(2)A受热分解的反应是高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)黑色固体G在无色气体B中得到H的反应是碳和氧气在点燃的条件下生成二氧化碳,化学方程式为:C+O2![]() CO2,检验气体H的方法是将气体通入澄清石灰水中,澄清石灰水变浑浊。故答案为:(1)KMnO4,H2O2,KClO3,C;(2)2KMnO4
CO2,检验气体H的方法是将气体通入澄清石灰水中,澄清石灰水变浑浊。故答案为:(1)KMnO4,H2O2,KClO3,C;(2)2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)C+O2![]() CO2,将气体通入澄清石灰水中,澄清石灰水变浑浊。
CO2,将气体通入澄清石灰水中,澄清石灰水变浑浊。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案