题目内容
【题目】向氧化铜和铁粉的混合物中加入一定量稀硫酸,充分反应后过滤,向滤渣中滴入稀硫酸,有气泡产生。下列判断正确的是( )
A. 滤渣中不可能含有CuB. 滤渣中不可能只含有Fe
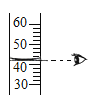
C. 滤液中可能含有![]() D. 滤液中可能含有
D. 滤液中可能含有![]()
【答案】B
【解析】
A、氧化铜能与稀硫酸反应生成硫酸铜和水,铁能与稀硫酸反应生成硫酸亚铁溶液和氢气,铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,滤渣中可能含有Cu,故选项说法错误。
B、向滤渣中滴入稀硫酸,有气泡产生,说明滤渣中一定含有Fe,铁有剩余,说明同时应含有铜,故选项说法正确。
C、由题意,滤液中一定含有FeSO4,不是可能含有硫酸亚铁,还可能还含有硫酸,故选项说法错误。
D、由于铁有剩余,滤液中不可能含有CuSO4,故选项说法错误。
故选:B。

【题目】小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
(探究目的)探究所得溶液的酸碱性。
(提出猜想)所得溶液可能呈碱性,也可能呈______性。
(实验验证)
实验操作 | 实验现象 | 结论 |
用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 ______ | 溶液呈碱性 |
无色酚酞试液不变色 | 溶液呈 ______ |
(分析与思考)
(1)若溶液呈碱性,为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入______溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为______。
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入金属锌,若观察到______,则所取溶液星酸性;若无明显现象,则呈中性。
方案二:取样,加入碳酸钠溶液,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为______,若无明显现象,则呈中性。
(3)工业上常用氢氧化钠来中和废水中的盐酸,现取废液50g,逐滴滴入10%的氢氧化钠溶液中和,当溶液pH为7时,用去氢氧化钠溶液8g。请计算废水中氯化氢的质量分数______。