题目内容
【题目】化学实验室里,某化学兴趣小组发现了一瓶标签受到腐蚀的无色溶液(如图所示),他们对此产生了兴趣。
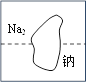
(提出问题)这瓶溶液究竟是什么?
(猜想假设)
猜想①:Na2CO3
猜想②:NaCl
猜想③:Na2SO4
小丹同学根据标签上的信息认为一定不可能的猜想是________。
(查阅资料)Na2SO4溶液显中性
(设计实验)为了确定该溶液究意是剩余两种盐的哪一种,设计如下实验:
实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取少量样品于试管中,慢慢滴加BaCl2溶液 | _______ | 猜想____成立 |
Ⅱ.向步骤Ⅰ中试管内继续加入过量稀盐酸 | 有大量气泡产生 |
(实验反思)
(1)写出实验步骤Ⅰ中发生的化学反应方程式_______________________。
(2)为达到实验目的,小丹认为上述设计实验还可简化,则下列实验操作可以是______(填序号)。
A.向样品中滴加酚酞试液看溶液的颜色变化
B.向样品中加入稀盐酸看是否有气泡产生
C.蒸发样品看是否有固体析出
【答案】 ② 有白色沉淀生成 ① Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl AB
【解析】本题通过缺失标签的药品成分的探究,考查了溶液的酸碱度测定,盐的化学性质。结合所给出问题情景和常见物质的检验、鉴别方法,根据所学的相关知识,认真地进行思考、推断、鉴别出药品的真实身份。
猜想假设:根据题干提供的信息进行分析,残缺的标签中Na的右下角有数字2,该物质不可能是氯化钠。故选②;
设计实验:实验步骤Ⅱ中加入盐酸反应产生大量的气泡,说明溶液的溶质是碳酸钠,氯化钡能与碳酸钠反应生成碳酸钡沉淀和氯化钠,实验步骤Ⅰ中产生的实验现象是有白色沉淀生成;
实验反思:(1)实验步骤Ⅰ中发生的化学反应方程式是Na2CO3 + BaCl2 = BaCO3↓+ 2NaCl;
(2)A、碳酸钠的水溶液呈碱性,能使酚酞试液变红色,硫酸钠的水溶液呈中性,不能使酚酞试液变红色,可以滴加酚酞试液的方法来确定物质的成分,正确;B、碳酸钠能与盐酸反应产生气体,硫酸钠不与盐酸反应,可以使用盐酸与样品混合,观察有无气体产生来确定物质的成分,正确;C、无论是碳酸钠还是硫酸钠蒸发样品都有固体析出,错误。故选AB。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案