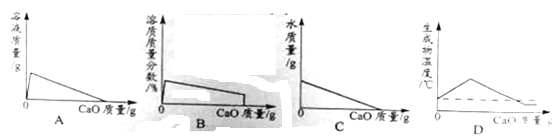
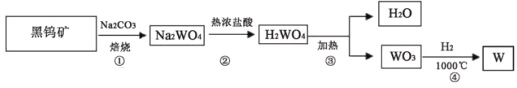
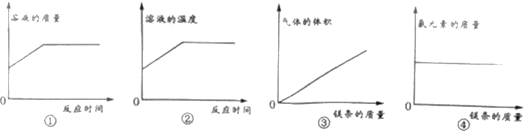
题目内容
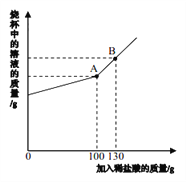
【题目】下图为两物质的溶解度曲线。请回答:
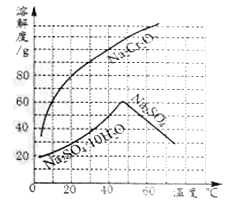
(1)50℃时,Na2Cr2O7的溶解度为______g;60℃时溶解度:Na2Cr2O7_______Na2SO4(填“<”、“=”、“>”)。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7______g(假设不含结晶水)。
【答案】 110 > 50
【解析】根据溶解度曲线分析解答。(1)由溶解度曲线可知,50℃时,Na2Cr2O7的溶解度为110g;由溶解度曲线可知,60℃时溶解度:Na2Cr2O7>Na2SO4;(2)由溶解度曲线可知,50℃时,Na2Cr2O7的溶解度为110g;10℃时,Na2Cr2O7的溶解度为60g。在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O750g。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】化学实验室里,某化学兴趣小组发现了一瓶标签受到腐蚀的无色溶液(如图所示),他们对此产生了兴趣。
(提出问题)这瓶溶液究竟是什么?
(猜想假设)
猜想①:Na2CO3
猜想②:NaCl
猜想③:Na2SO4
小丹同学根据标签上的信息认为一定不可能的猜想是________。
(查阅资料)Na2SO4溶液显中性
(设计实验)为了确定该溶液究意是剩余两种盐的哪一种,设计如下实验:
实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取少量样品于试管中,慢慢滴加BaCl2溶液 | _______ | 猜想____成立 |
Ⅱ.向步骤Ⅰ中试管内继续加入过量稀盐酸 | 有大量气泡产生 |
(实验反思)
(1)写出实验步骤Ⅰ中发生的化学反应方程式_______________________。
(2)为达到实验目的,小丹认为上述设计实验还可简化,则下列实验操作可以是______(填序号)。
A.向样品中滴加酚酞试液看溶液的颜色变化
B.向样品中加入稀盐酸看是否有气泡产生
C.蒸发样品看是否有固体析出