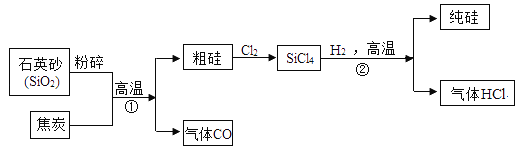
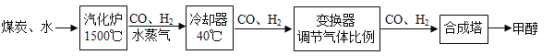
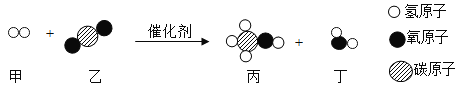
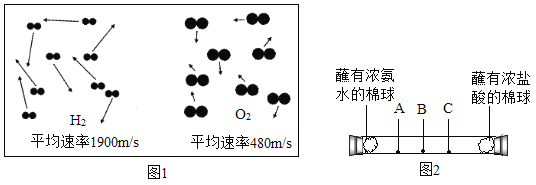
题目内容
【题目】25°C时,向一定量的稀盐酸中不断滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示,下列有关叙述正确的是
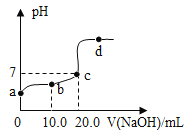
A.向b点对应的溶液中滴加石蕊试液,溶液呈现无色
B.d点对应的溶液中溶质是NaCl和NaOH(溶质不考虑石蕊试液)
C.该反应的实质是H+和OH-结合生成H2O
D.b、d点对应溶液的pH: b>d
【答案】BC
【解析】
本题是往酸滴碱的中和反应,在反应过程中溶质与pH的变化关系,选择正确的。
A、b点溶液pH小于7,溶液呈酸性,溶液中盐酸过量,向b点对应的溶液中滴加石蕊试液,溶液呈现红色,而不是无色,不符合题意;
B、d点溶液pH大于7,盐酸已反应完,溶液中氢氧化钠过量,对应的溶液中溶质有生成的NaCl和过量的NaOH,符合题意;
C、该反应是酸碱中和反应,酸起主要作用的是H+,碱起主要作用的是OH-,所以反应的实质是H+和OH-结合生成H2O,答合题意;
D、b点溶液pH小于7,d点溶液pH大于7,b、d点对应溶液的pH: b<d,不符合题意.故选BC。

 新题型全程检测期末冲刺100分系列答案
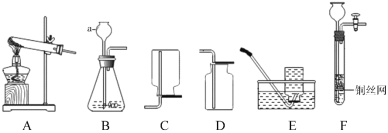
新题型全程检测期末冲刺100分系列答案【题目】小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
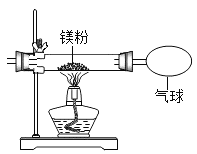
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(作出猜想)黄色固体是Mg3N2。
(实验探究)设计实验,验证猜想:
实验操作 | 实验现象及结论 |
__________ | ___________ |
(反思与交流)①空气中N2的含量远大于O2的含量,可是镁条在空气中的燃烧产物MgO却远多于Mg3N2,合理的解释是________。
②同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识________。