题目内容
【题目】有一瓶气体,可能是 CO、 CO2 、 H2O 、 H2 中的一种或几种组成。为了分析该气体的成分,取适量该气体进行实验,实验方案设计如下:
(提示:Ⅰ.浓硫酸具有吸水性,能干燥某些气体;Ⅱ.假设每一步都吸收完全;Ⅲ.氢气还原氧化铜得到铜和水)。
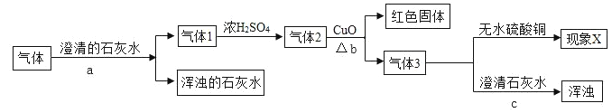
①上述可能存在的气体中,易与血红蛋白结合的气体是________。
②通过步骤 a 能确定一定含有的气体是_______。
③实验中如没有用浓 H2SO4 干燥气体 1,对气体检验______(选填“有”或“无”)影响。
④若现象 X 为“无水硫酸铜变蓝色”,结论是气体中__________;若现象 X 为“无水硫酸铜不变色”,结论是气体中_________。
⑤b 中一定发生的反应方程式是________________。
⑥该实验不能确定是否含有 H2O 蒸汽,改进的实验方案是_________________。
【答案】CO CO2 有 一定含有 H2 一定不含 H2 CO+CuO ![]() Cu+CO 2 在操作 a 前先通入装有无水 CuSO4 的装置
Cu+CO 2 在操作 a 前先通入装有无水 CuSO4 的装置
【解析】
(1)CO易与血红蛋白结合,导致中毒死亡;
(2) 步骤 a为气体通入澄清石灰水,石灰水变浑浊,故混合气体中一定含有CO2;
(3) 实验中如没有用浓 H2SO4 干燥气体 1,将会无法证明H2O是混合气体中的,还是气体3反应生成的,故对气体检验有影响;
(4) 若现象 X 为“无水硫酸铜变蓝色”,证明氢气与氧化铜的反应发生了,故该气体中一定含有H2;
若现象 X 为“无水硫酸铜不变色”,证明氢气与氧化铜的反应没发生,故该气体中一定不含H2;
(5)因为气体3中通入澄清石灰水,石灰水变浑浊,所以,一氧化碳与氧化铜的反应发生了,化学方程式为CO+CuO ![]() Cu+CO 2
Cu+CO 2
(6)该实验因为混合气体首先通入澄清石灰水,所以,不能确定是否含有 H2O 蒸汽,改进方案为在操作 a 前先通入装有无水 CuSO4 的装置