题目内容
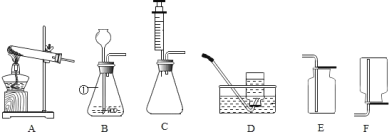
【题目】下图为实验室常见的一些实验装置,请回答下列问题。
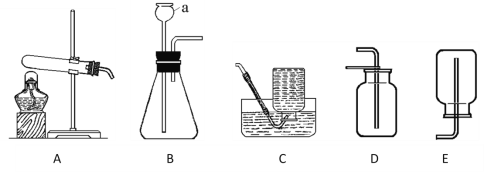
(1)B中仪器a的名称为_____。实验室用高锰酸钾制取氧气,需在A中的试管口处放一小团棉花,其目的是_______,收集装置可用C或_______(填序号,下同)。
(2)实验室可用锌粒与稀硫酸反应制取H2,应该选用的发生装置是______。
(3)实验室常用稀盐酸和石灰石制取二氧化碳,该反应的化学方程式为__________。检验二氧化碳的方法是_________(答出操作、现象和结论)。
【答案】长颈漏斗 防止加热时高锰酸钾粉末进入导管 D B CaCO3+2HCl=CaCl2+CO2↑+H2O 将气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明该气体为二氧化碳(合理给分)
【解析】
(1)长颈漏斗方便加液体药品,加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;收集装置可用D;
(2)实验室是用锌粒和稀硫酸在常温下反应制氢气的,因此不需要加热,应该选用的发生装置是B;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,因此不需要加热;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳。

 金钥匙试卷系列答案
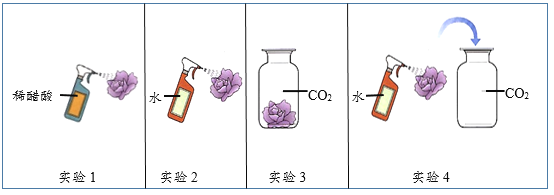
金钥匙试卷系列答案【题目】科学探究和证据推理是化学学科的核心素养。化学兴趣小组对“测定空气中氧气的含量”实验进行探究,并基于证据进行推理分析。
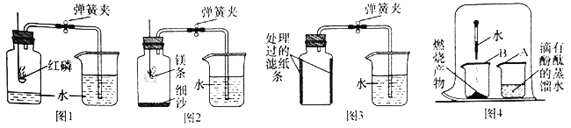
I.用红磷测定空气中氧气的含量
(1)写出红磷在空气中燃烧的化学方程式:___________。
(2)某同学利用图1所示装置进行实验,步骤如下:
①用弹簧夹夹紧胶皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③___________;
④观察并记录水面的变化情况。
多次实验发现,集气瓶内水平面上升始终小于1/5。
Ⅱ.用镁条测定空气中氧气的含量
(3)某同学进行图2所示实验时发现,产物中有少许黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与空气中的___________反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气。
(做出猜想)黄色固体为Mg3N2
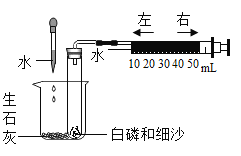
(实验过程)进行图4所示实验:取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
(实验结论)观察到的现象是___________,据此可推断燃烧产物中含氮化镁(Mg3N2)。
(反思交流)进行图2所示实验时,在确保规范操作的前提下,该同学所测得的空气中氧气的体积分数___________(填“大于”“小于”或“等于”)1/5。
Ⅲ.用铁粉测定空气中氧气的含量
(4)某同学利用铁生锈的原理,用铁粉测定空气中氧气的含量,实验装置如图3所示。当烧杯中不再有水进入集气瓶时,该同学停止实验。实验开始和结束时所采集的数据如下表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内水 | 烧杯内剩余水 |
250mL | 180.0mL | 129.5mL |
①铁生锈的原理是铁与空气中的___________发生反应。
②实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再将滤纸条贴在集气瓶内壁,其目的是___________。
③该同学所测得的空气中氧气的体积分数为___________(精确到0.1%)。
④与红磷燃烧法相比,用该法测定空气中氧气含量的主要优点是___________。
Ⅳ.拓展应用
(5)取2.4g镁条在足量O2和N2的混合气体中完全燃烧,所得固体质量为a g,则a的取值范围是3.3<a<___________。