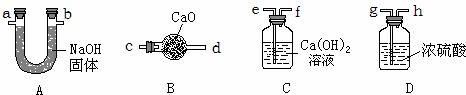题目内容
(1)若用氯酸钾和二氧化锰来制取氧气,该反应的化学方程式为______△2KCl+3O2↑
【答案】分析:(1)根据氯酸钾制氧气的原理书写化学方程式;根据反应前后物质的质量和状态分析二氧化锰的质量分数;
(2)根据固体提纯的步骤进行分析;
(3)根据蒸发和过滤时的仪器进行分析;
(4)①根据质量分数的计算进行分析;②根据量筒的使用规则进行分析;
(5)氢氧化钾和盐酸反应生成氯化钾溶液,根据题中的数据找出等量关系进行解答.
解答:解:(1)氯酸钾在二氧化锰的催化作用下加热会生成氯化钾和氧气,该反应中反应后固体质量减小,所以二氧化锰质量分数增大,
(2)回收二氧化锰需要先将混合物配成溶液,二氧化锰不溶于水,然后进行过滤,洗涤固体,最后进行烘干,其顺序为:bdca;
(3)蒸发需要的仪器有蒸发皿.玻璃棒、酒精灯等,过滤需要的仪器有烧杯、玻璃棒、铁架台等,都需用到的仪器是玻璃棒;
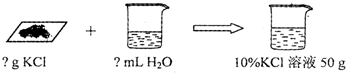
(4)①根据溶质质量=溶液质量×溶质质量分数,氯化钾固体的质量为50×10%=5g,水就是50g-5g=45g,体积为45mL;
②选用量筒需要就近原则,45g水的体积是45mL,故选50mL的量筒;
(5)氢氧化钾和盐酸反应生成氯化钾,所得溶液为氯化钾溶液,可根据氢氧化钾的质量根据化学方程式进行计算;
故答案为:(1)2KClO3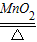 2KCl+3O2↑;变大;
2KCl+3O2↑;变大;
(2)bdca
(3)C
(4)①5 45 ②50 ④KCl 10%
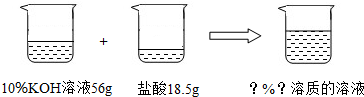
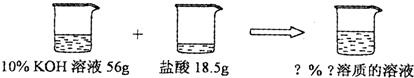
(5)解:56gKOH溶液中KOH的质量为56g×10%=5.6g
设反应后生成KCl的质量为x
KOH+HCl=KCl+H2O
56 74.5
5.6g x
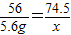
x=7.45g
反应后溶液的溶质质量分数=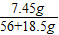 ×100%=10%
×100%=10%
答:反应后氯化钾溶液的溶质质量分数为10%.
点评:在解此类题时,首先分析考查的问题,然后结合学过的知识和题中所给的信息和数据进行分析解答,本题主要考查了过滤和蒸发操作及溶液的有关计算.
(2)根据固体提纯的步骤进行分析;
(3)根据蒸发和过滤时的仪器进行分析;
(4)①根据质量分数的计算进行分析;②根据量筒的使用规则进行分析;
(5)氢氧化钾和盐酸反应生成氯化钾溶液,根据题中的数据找出等量关系进行解答.
解答:解:(1)氯酸钾在二氧化锰的催化作用下加热会生成氯化钾和氧气,该反应中反应后固体质量减小,所以二氧化锰质量分数增大,
(2)回收二氧化锰需要先将混合物配成溶液,二氧化锰不溶于水,然后进行过滤,洗涤固体,最后进行烘干,其顺序为:bdca;
(3)蒸发需要的仪器有蒸发皿.玻璃棒、酒精灯等,过滤需要的仪器有烧杯、玻璃棒、铁架台等,都需用到的仪器是玻璃棒;
(4)①根据溶质质量=溶液质量×溶质质量分数,氯化钾固体的质量为50×10%=5g,水就是50g-5g=45g,体积为45mL;
②选用量筒需要就近原则,45g水的体积是45mL,故选50mL的量筒;
(5)氢氧化钾和盐酸反应生成氯化钾,所得溶液为氯化钾溶液,可根据氢氧化钾的质量根据化学方程式进行计算;
故答案为:(1)2KClO3
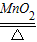 2KCl+3O2↑;变大;
2KCl+3O2↑;变大;(2)bdca
(3)C
(4)①5 45 ②50 ④KCl 10%
(5)解:56gKOH溶液中KOH的质量为56g×10%=5.6g
设反应后生成KCl的质量为x
KOH+HCl=KCl+H2O
56 74.5
5.6g x
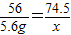
x=7.45g
反应后溶液的溶质质量分数=
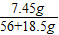 ×100%=10%
×100%=10%答:反应后氯化钾溶液的溶质质量分数为10%.
点评:在解此类题时,首先分析考查的问题,然后结合学过的知识和题中所给的信息和数据进行分析解答,本题主要考查了过滤和蒸发操作及溶液的有关计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 (3)若要得到干燥的CO2,图(一)还需要一个干燥装置,干燥剂为浓硫酸.图(二)画出了该干燥装置的一部分,请你补充画出其它部分,并用箭头标明气体进出方向.
(3)若要得到干燥的CO2,图(一)还需要一个干燥装置,干燥剂为浓硫酸.图(二)画出了该干燥装置的一部分,请你补充画出其它部分,并用箭头标明气体进出方向.


 26、实验室提供了以下仪器,请你随某兴趣小组的同学一起来参加实验探究活动:
26、实验室提供了以下仪器,请你随某兴趣小组的同学一起来参加实验探究活动: