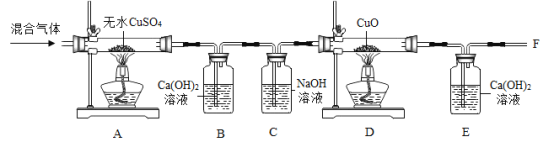
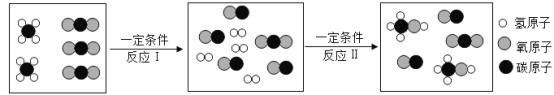
题目内容
【题目】硫酸及硫酸盐的用途非常广泛,以黄铁矿为原料生产硫酸的工业流程如下图所示:
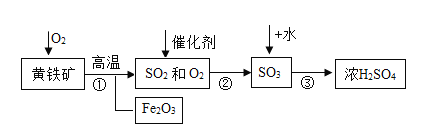
(1)黄铁矿与氧气反应前必须先进行粉碎处理,其目的是_______________。
(2)已知黄铁矿(主要成分用X表示)与空气发生反应的化学方程式为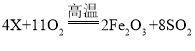 ,请推断出黄铁矿主要成分的化学式:__________________;反应后的矿渣的主要成分为Fe2O3,它在工业上还可用于______________。
,请推断出黄铁矿主要成分的化学式:__________________;反应后的矿渣的主要成分为Fe2O3,它在工业上还可用于______________。
(3)步骤②中发生的反应的基本反应类型为_______________。
(4)要把100g溶质质量分数为98%的浓硫酸稀释成质量分数为10%的硫酸,需要水的质量是______________g,实验室稀释浓硫酸时应注意_______________。
【答案】增大反应物之间的接触面积,使反应更充分 FeS2 炼铁 化合反应 880 将浓硫酸沿器壁慢慢倒入水中,边倒边搅拌,切不可将水倒入浓硫酸中
【解析】
(1)将黄铁矿进行粉碎处理,可以增大反应物之间的接触面积,提高反应速率,使反应更充分;
(2)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含22个氧原子,生成物中含4个铁原子、22个氧原子、8个硫原子,故反应物中还应含4个铁原子、8个硫原子,故X的化学式为:FeS2;
工业上通常用一氧化碳与三氧化二铁在高温的条件下炼铁,故填:炼铁;
(3)步骤②中发生的反应为二氧化硫与氧气在催化剂的作用下生成三氧化硫,该反应符合“多变一”的特点,属于化合反应;
(4)设需要加水的质量为x,100g×98%=(100g+x)×10%,x=880g;
稀释浓硫酸时应注意:将浓硫酸沿器壁慢慢倒入水中,边倒边搅拌,切不可将水倒入浓硫酸中。

【题目】实验室中有一瓶标签受损的无色液体,如图所示。这瓶无色液体是什么呢?实验员老师告诉大家,该液体可能是过氧化氢溶液、稀盐酸、稀硫酸和蒸馏水中的一种。
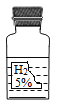
(1)大家讨论后一致认为不可能是蒸馏水,理由是_____;同时也不可能是稀盐酸,理由是_____。
(2)为确定该液体成分,同学们继续进行了如下实验探究:
实验操作 | 实验现象 | 实验结论 |
步骤一:取该液体适量于试管中,向其中加入_____ | _____ | 该液体不是过氧化氢溶液。 |
步骤二:_____ | _____ | 该液体是稀硫酸 |
(反思交流)
①大家认为标签受损的原因可能是_____;
②如果该液体是过氧化氢溶液,则步骤一中产生的变化用化学方程式表示为_____。