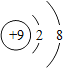题目内容
【题目】某同学为了探究相关金属的化学性质,做了下列实验:

(1)A试管中实验现象是_____。
(2)只通过A和B实验尚不能证明铜、银两种金属的活动性强弱,需补充一个实验来证明,补充实验所用试剂不合理的是_____。
A Cu、Ag、稀盐酸 B Cu、AgNO3溶液 C Cu(NO3)2溶液、Ag
(3)实验C中物质充分反应后,某同学对试管中固体的成分提出以下四种猜想:
A Zn、Cu、Ag B Zn、Cu C Cu、Ag D Ag
这四种猜想中你认为有可能的是_____(填编号)。
【答案】锌片表面有红色固体生成,溶液由蓝色逐渐变为无色 A ACD
【解析】
(1)A试管中锌与硝酸铜反应生成了硝酸锌和铜,实验现象为:锌片表面有红色固体生成,溶液由蓝色逐渐变为无色;
(2)A、铜、银都不能与稀盐酸反应,无法比较铜、银的活泼性强弱,试剂不合理,符合题意;
B、Cu能与AgNO3溶液反应,将Ag置换出来,从而说明铜的活动性强于银,试剂合理;
C、Ag不能与Cu(NO3)2溶液反应,不能将Cu置换出来,从而说明铜的活动性强于银,试剂合理;
故选A;
(3)A、当Zn过量时,固体中含有Zn、Cu、Ag,此猜想合理;
B、银的活泼性最弱,最先被置换出来,所以固体中一定有银,此猜想不合理;
C、当Zn不足或恰好反应时,固体中有Cu、Ag,此猜想合理;
D、当Zn不足,还未能将所有银置换出来便消耗完全,则固体中只有Ag,此猜想合理;
故选ACD。

【题目】某化学兴趣小组的同学在做酸碱中和反应的实验时,向盛有氢氧化钙溶液的烧杯中加入一定量的稀盐酸后,忘了滴加酚酞溶液,不知道盐酸是否过量。于是他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行了探究。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想与假设]猜想一:溶质只有CaCl2
猜想二:_________________________。
猜想三:溶质中含有CaCl2和Ca(OH)2;
猜想四:溶质中含有CaCl2、HCl和Ca(OH)2。
[交流讨论]同学们讨论后一致认为猜想四不合理,理由是__________(用化学方程式表示)。
[查阅资料]氯化钙溶液呈中性。
[实验设计]同学们设计了如下不同的实验方案,请完成下列表格。
方案 | 操作步骤 | 实验现象 | 实验结论 |
一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
酚酞变红色 | 猜想三正确 | ||
二 | 取少量烧杯内的溶液于试管中,逐滴加入____________溶液至过量 | _____________ | 猜想二正确 |
[反思交流]方案一不能证明猜想一是否正确,理由是______________。若要完善此方案,可将酚酞溶液换成______________。
[拓展与应用]实验证明猜想二是正确的,要使烧杯内溶液的溶质只含有CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的__________,然后过滤。
[拓展延伸]在发生化学反应的过程中还伴随着温度的变化。室温下,将稀盐酸慢慢滴入装有氢氧化钙溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液的温度随加入稀盐酸的质量而变化的曲线如图所示:
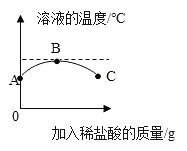
(1)由图可知,盐酸与氢氧化钙溶液发生的中和反应是_____________(填“吸热”“放热”或“无热量变化”)反应。
(2)向A点对应的溶液中加入紫色石蕊溶液,溶液呈_____________色。
(3)B点对应的溶液中的溶质是_______________(填化学式)。
(4)B到C的过程中溶液的pH逐渐________________(填“增大”“减小”或“无变化”)。
【题目】分类是学习化学常用的方法。
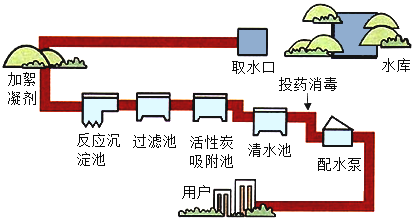
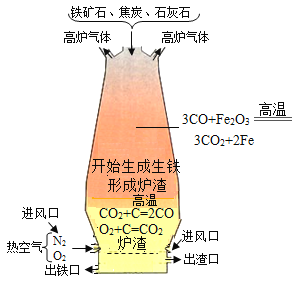
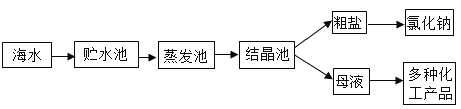
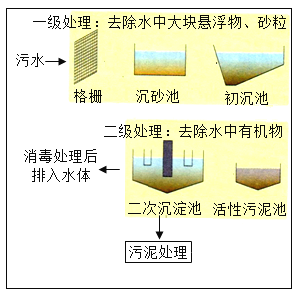
(1)工艺流程(或过程)图的内容往往与生产、生活实际联系密切。过程图的设计形式各异,有的以物质或操作名称作为框图的流程设计,有的以设备内化学反应过程为流程来设计生产,从流程图的设计来看,可以将C过程与__________过程分为一组,分类依据是____________________。
|
|
|
|
A.自来水厂净水过程 | B.炼铁高炉内反应过程 | C.海水提取粗盐的过程 | D.污水处理过程 |
(2)在海水提取粗盐的过程中可以获得氯化钠,其用途广泛,工业上可以用氯化钠、氨气和二氧化碳为原料来制得碳酸钠,反应分三步进行:①NH3+CO2+H2O=NH4HCO3,②NH4HCO3+NaCl=NaHCO3+NH4Cl,③2NaHCO3![]() Na2CO3+CO2↑+H2O,从上述三个反应分析来看可以回收再利用的物质是__________________;从上面的反应来看在获得纯碱的同时又可以获得氮肥,但须注意的是在刚用熟石灰改良过的土壤中不能使用此氮肥,其原因是:_______________(用化学方程式表示)。
Na2CO3+CO2↑+H2O,从上述三个反应分析来看可以回收再利用的物质是__________________;从上面的反应来看在获得纯碱的同时又可以获得氮肥,但须注意的是在刚用熟石灰改良过的土壤中不能使用此氮肥,其原因是:_______________(用化学方程式表示)。
【题目】下列与化学有关的知识完全正确的一组是( )
A | ①鉴别硝酸铵和硫酸铵——加熟石灰研磨,闻气味 ②吃水果——可以补充维生素 ③墙内开花墙外香——分子不断运动 | B | ① ②Mg2+——“2”表示一个镁离子带2个单位正电荷 ③C1O2中氯元素的化合价+4价 |
C | ①食品包装填充氧气——防止变质 ②加碘食盐——补充碘元素 | D | ①活性炭净水——吸附色素和异味 ②常用水冲洗铁制品——防止铁生锈 ③硬水和软水——加肥皂水可以区分 |
A.AB.BC.CD.D