题目内容
【题目】(科学探究)
同学们用如图装置探究燃烧的条件。(白的着火点为40℃,红磷的着火点为240℃)

(1)实验中,热水的作用是_____和_____。
(2)实验开始后,观察到的现象是_____,有关反应的化学方程式是_____。对比两处白磷的实验现象,得出的结论是_____,由此可知实验室中的白磷应保存在_____中。
(3)同学们通过学习还知道,可燃物燃烧的剧烈程度除了与可燃物的性质有关外,还取决于可燃物与氧气的接触面积和氧气的浓度。请你选择一个因素设计实验进行验证。
①实验目的:_____。
②实验操作;_____。
③实验现象:_____。
【答案】提供热量 隔绝氧气 铜片上白磷燃烧 ![]() 燃烧需要氧气 冷水 ①探究可燃物燃烧的剧烈程度取决于可燃物与氧气的接触面积 ②取粗细不同的铁丝,分别点燃放入等体积盛有纯氧气的集气瓶中燃烧 ③粗铁丝不燃烧,细铁丝剧烈燃烧
燃烧需要氧气 冷水 ①探究可燃物燃烧的剧烈程度取决于可燃物与氧气的接触面积 ②取粗细不同的铁丝,分别点燃放入等体积盛有纯氧气的集气瓶中燃烧 ③粗铁丝不燃烧,细铁丝剧烈燃烧
【解析】
解:(1)白磷的着火点是40℃,热水能使白磷的温度达到着火点;水中的白磷温度达到了着火点,但是没有与氧气接触,没有燃烧,故填:提供热量;隔绝氧气;
(2)铜片上的白磷与氧气接触,且温度达到了白磷的着火点,所以实验开始后,观察到铜片上白磷燃烧,磷与氧气在点燃的条件下反应生成五氧化二磷;而水中的白磷温度达到了着火点,但是没有与氧气接触,没有燃烧,对比可知,燃烧需要氧气;白磷应该保存在冷水中;故填:铜片上白磷燃烧;![]() ;燃烧需要氧气;冷水;
;燃烧需要氧气;冷水;
(3)若探究可燃物燃烧的剧烈程度取决于可燃物与氧气的接触面积,可设计如下实验:取粗细不同的铁丝,分别点燃放入等体积盛有纯氧气的集气瓶中燃烧,粗铁丝不燃烧,细铁丝剧烈燃烧;
若探究可燃物燃烧的剧烈程度还取决于氧气的浓度时,可设计如下实验:取等质量的硫,分别点燃放入等体积盛有空气和氧气集气瓶中燃烧,观察到在空气中燃烧时发出淡蓝色的火焰,而在氧气中燃烧时发出明亮的蓝紫色的火焰。
故填:①探究可燃物燃烧的剧烈程度取决于可燃物与氧气的接触面积;②取粗细不同的铁丝,分别点燃放入等体积盛有纯氧气的集气瓶中燃烧;③粗铁丝不燃烧,细铁丝剧烈燃烧(答案合理即可)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
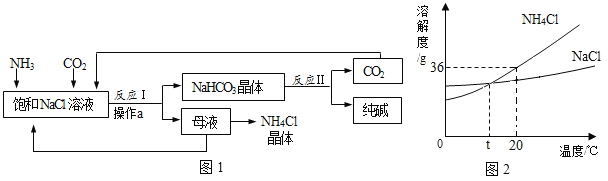
小学生10分钟应用题系列答案【题目】分析处理图表中的信息是学习化学的一种重要方法.
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
①40℃时,氯化钠的溶解度为_____g.
②碳酸钠的溶解度随温度的升高而_____(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是_____(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为_____(计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是_____.
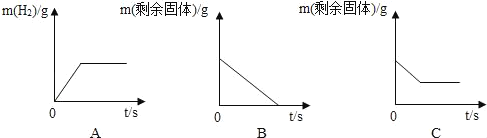
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式_____.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是_____(填标号).
【题目】在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气.某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出.加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
编号 | 1 | 2 | 3 | 4 |
加水的质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
试求:(1)表中m值为______;
(2)混合物中KClO3的质量______;
(3)所制得氧气的质量______(写出具体计算过程).
【题目】如图所示,装置气密性良好,弹簧夹处于关闭状态。向试管中加入下表中的物质,挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能使气球a明显鼓起的是( )
试管内物质 | 胶头滴管内物质 | |
A | 氢氧化钠固体 | 水 |
B | 铁粉 | 稀盐酸 |
C | 氯化钡溶液 | 稀硫酸 |
D | 二氧化碳 | 氢氧化钠溶液 |
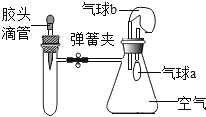
A. AB. BC. CD. D