题目内容
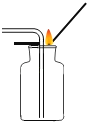
【题目】根据如图装置图,回答有关问题.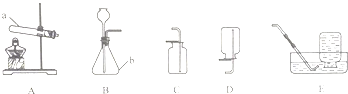
(1)写出装置图中标号仪器的名称:a , b .
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式 , 可选用的发生装置是(填字母).
(3)写出实验室用高锰酸钾制取氧气的化学方程式 , 如图E装置来收集氢气,当导管口气泡放出时,再把导管口伸入盛满水的集气瓶,开始收集.
【答案】
(1)试管;锥形瓶
(2)2H2O2![]() 2H2O+O2↑;B
2H2O+O2↑;B
(3)2KMnO4![]() K2MnO4+MnO2+O2↑;均匀连续
K2MnO4+MnO2+O2↑;均匀连续
【解析】(1)根据实验室常用仪器可知:a试管;b锥形瓶;(2)实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式:2H2O2![]() 2H2O+O2↑;反应不需加热,属于固液常温型,可选用的发生装置是B;(3)实验室用高锰酸钾制取氧气的化学方程式为:2KMnO4
2H2O+O2↑;反应不需加热,属于固液常温型,可选用的发生装置是B;(3)实验室用高锰酸钾制取氧气的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;如图E装置来收集氢气,当导管口气泡均匀连续放出时,再把导管口伸入盛满水的集气瓶,开始收集. 答案:(1)a试管;b锥形瓶;(2)2H2O2
K2MnO4+MnO2+O2↑;如图E装置来收集氢气,当导管口气泡均匀连续放出时,再把导管口伸入盛满水的集气瓶,开始收集. 答案:(1)a试管;b锥形瓶;(2)2H2O2![]() 2H2O+O2↑;B;(3)2KMnO4
2H2O+O2↑;B;(3)2KMnO4![]() K2MnO4+MnO2+O2↑;均匀连续.
K2MnO4+MnO2+O2↑;均匀连续.
【考点精析】本题主要考查了氧气的制取装置和氧气的收集方法的相关知识点,需要掌握发生装置:固固加热型、固液不加热型;收集装置:根据物质的密度、溶解性;排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气;)用排空气法收集气体时,导管伸到集气瓶底部才能正确解答此题.

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】探究影响化学反应速率的因素
(1)发现和提出问题
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是 .
蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率,温度如何影响反应速率呢?
(2)猜想与假设
温度越高,反应速率越快
收集证据
实验药品:颗粒大小相同的锌粒;两份相同溶质质量分数.不同温度的稀硫酸(20℃、40℃)
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支.利用上述仪器和药品,补充完成下表的实验报告.
观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 | 温度越高,反应速率越快.反应的化学方程式是 |
该实验可以观察或测量的量有多种,除了上述观测点外,可以观察或测量的量还有(写一条) .
(3)结论与解释
从微观的角度分析“温度越高,反应速率越快”的原因是 .
(4)拓展分析
根据其他测定方位,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示,请据图分析:时间0﹣t内,反应速率逐渐加快的主要原因是 , 时间t以后,反应速率逐渐减慢的主要原因是 . 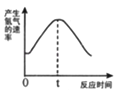
【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案. 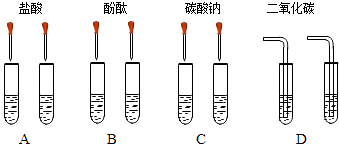
(1)其中能达到实验目的是
(2)在C组实验中发生的化学方程式为
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有物质生成(填化学式),滴入酚酞后溶液呈红色.
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性.使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和三种物质中的一种,或是三种物质两两混合组成的混合物.
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证.请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是 .