题目内容
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题.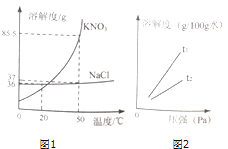
(1)硬水是指含有较多的水,在生活中常采用的方法降低水的硬度.
(2)NaCl、KNO3两种物质的溶解度曲线如图所示.
在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是(填字母),在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是(填字母).
A.大于 B.小于 C.等于 D.无法确定
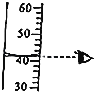
(3)不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度(填字母)
A.大于40℃
B.小于40℃
C.无法确定
(4)若用溶质质量分数为16%的NaCl溶液和蒸馏水配制100g溶质质量分数为10%的NaCl溶液,则所需16%的NaCl溶液与蒸馏水的质量比为 .
【答案】
(1)可溶性钙、镁化合物;煮沸
(2)B;D
(3)A
(4)5:3
【解析】解:(1)硬水是指含有较多可溶性钙镁化合物的水,在生活中常采用煮沸的方法降低水的硬度;
(2)在20℃时,KNO3的溶解度小于NaCl的溶解度,所以前者与后者的关系是B,在50℃时,溶液的状态不能确定,所以KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是D;
(3)气体的溶解度随温度的升高而减小,不同温度下,氧气的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度大于40℃,故选A;(4)若用溶质质量分数为16%的NaCl溶液和蒸馏水配制100g溶质质量分数为10%的NaCl溶液,需要所需16%的NaCl溶液质量为: ![]() =62.5g,需要蒸馏水的质量为:100g﹣62.5g=37.5g,所以所需16%的NaCl溶液与蒸馏水的质量比为62.5g:37.5g=5:3.
=62.5g,需要蒸馏水的质量为:100g﹣62.5g=37.5g,所以所需16%的NaCl溶液与蒸馏水的质量比为62.5g:37.5g=5:3.
所以答案是:(1)可溶性钙镁化合物,煮沸;(2)B,D;(3)A;(4)5:3.
【考点精析】本题主要考查了硬水与软水和固体溶解度曲线及其作用的相关知识点,需要掌握硬水和软水的鉴别方法:用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)才能正确解答此题.

 天天练口算系列答案
天天练口算系列答案