题目内容
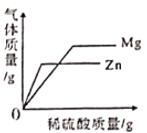
【题目】取一定量镁、锌、铝三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等。下列做法能达到上述结果的是( )
A. 相同质量的三种金属与足量的稀盐酸反应
B. 足量的三种金属与等量的稀盐酸反应
C. 向足量的镁、锌、铝中加入稀盐酸的质量比为2︰2︰3
D. 2.4 g镁、6.5 g锌、2.7g铝与足量的稀盐酸反应
【答案】B
【解析】
A、根据金属与酸反应生成氢气的质量关系:
![]()
![]()
![]()
可以看出,金属的质量相同,生成氢气的质量不等,铝产生氢气最多,锌产生氢气最少,故A错误;
B、因为产生氢气的是盐酸中的氢离子,故参与反应的HCl的质量相等,产生的氢气的质量就相等,故B正确;
C、由于产生的氢气是盐酸中的氢离子,消耗的盐酸“质量比为2:2:3”,不相同,产生的氢气也是不相同的,故C错误;
D、假设Mg、Zn、Al三种金属分别跟稀盐酸充分反应,得到氢气的质量都是2g,设参与反应的Al的质量为x,Mg的质量为y,Zn的质量为z,
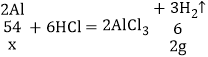
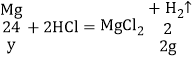
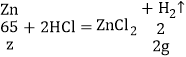
![]() y=24g,
y=24g,
![]() z=65g,
z=65g,
![]() x=18g,
x=18g,
故Mg、Zn、Al的质量比为:24g:65g:18g=24:65:18.则“2.4 g镁、6.5 g锌、2.7g铝与足量的稀盐酸反应”分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量不相等,故D错误。
故选B。

【题目】某化学兴趣小组获得两包制作“跳跳糖”的添加剂。一包是柠檬水晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。为确定白色粉末的化学成分进行了以下探究:
(提出猜想)猜想1:碳酸钠;猜想2:碳酸氢钠;猜想3:碳酸钠和碳酸氢钠
(查阅资料)①碳酸钠溶液,碳酸氢钠溶液均呈碱性;
②碳酸氢钠受热分解生成碳酸钠,水和二氧化碳;碳酸钠受热不分解。
(实验探究)小亮,小刚分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小亮 | 将白色粉末溶于水后pH试纸测定其酸碱度。 | pH__________(填“>”或“<”或“=”)7。 | 溶液呈碱性,猜想1成立。 |
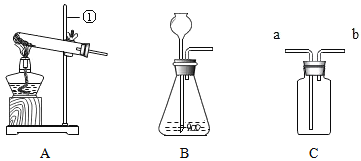
小刚 | 用右图所示的装置进行实验。 | 试管A中有水珠产生,试管B中液体变浑浊。 | 猜想2成立,试管B中反应的化学方程式为__________。 |
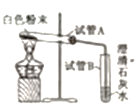
(实验质疑)
(1)小红认为小亮的实验结论不正确,理由是__________。(用文字叙述)
(2)小明认为小刚的实验并不能得出猜想2成立,理由是__________。(用文字叙述)
(实验探究2)
为了进一步确定白色粉末的化学成分,小威称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳质量为mg。通过计算并分析实验数据确定猜想3成立,则m的取值范围为__________(计算结果用分数表示)。
(结论分析)
探究后他们查到该白色粉末的成分为碳酸氢钠。那么你认为白色粉末中的碳酸钠是如何产生的?写出产生碳酸钠的化学方程式__________。