题目内容
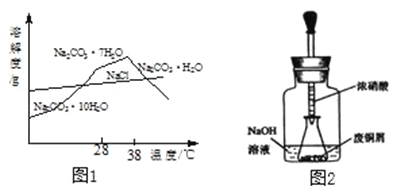
【题目】某小组同学对“一次性发热贴”(标签如图1)产生了兴趣,便打开用过的发热贴,发现内部是褐色固体,于是展开探究。


(查阅资料)发热贴的发热原理是铁粉在空气中发生缓慢氧化放出热量。
(问题1)发热贴中的铁粉是否完全被氧化?
(猜想)猜想Ⅰ:铁粉完全被氧化 猜想Ⅱ:铁粉部分被氧化
(探究1)取褐色固体于烧杯中,加入足量稀盐酸,无气泡产生,充分反应后过滤,滤液为黄色,滤渣为黑色。用化学方程式表示溶液变黄的原因____________________________________________。
根据实验现象可知,猜想_______成立。
(问题2)黑色滤渣中含有什么物质?
(探究2)同学们将上述滤渣干燥后,在充满氧气的集气瓶中充分燃烧,观察到滤渣剧烈燃烧,发出白光。向瓶中注入澄清石灰水,石灰水变浑浊。说明滤渣中有______________。结合已有知识和资料,分析可知该物质也是发热贴中的一种成分。
部分同学还想验证发热贴中存在氯化钠,他们取(探究1)中的黄色滤液,滴加AgNO3溶液,观察到__________________________,则认为发热贴中存在氯化钠。
某同学认为该实验不能证明发热贴中一定存在氯化钠,理由是_____________________________。
(问题3)发热贴中氯化钠起什么作用?
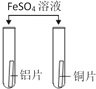
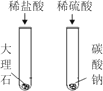
(探究3)同学们结合资料,回顾相关知识,联想到铁锈蚀不仅与水和氧气有关,还可能与盐分有关,设计并进行如图2实验,观察到B中铁粉生锈较快。
(表达交流)你认为发热贴中氯化钠的作用是_________________________________。
【答案】Fe2O3+6HCl=2FeCl3+3H2O Ⅰ 碳(或C) 有白色沉淀产生 FeCl3和AgNO3溶液反应也能产生白色沉淀 加快铁粉生锈
【解析】
探究1:
加入足量稀盐酸,无气泡产生,说明固体中无铁;氧化铁与盐酸反应生成氯化铁和水,化学反应方程式:Fe2O3+6HCl=2FeCl3+3H2O,氯化铁溶液为黄色;故猜想Ⅰ正确;
探究2
碳燃烧生成二氧化碳,二氧化碳使澄清石灰水变浑浊,说明滤渣中有碳;氯化银为不溶于水的白色沉淀;[探究1]中滴加AgNO3溶液,观察到有白色沉淀产生,说明溶液中可能有氯化钠,黄色滤液中含有氯化铁,FeCl3和AgNO3溶液反应也能产生白色沉淀故该实验不能证明发热贴中一定存在氯化钠;
探究3:
氯化钠能加快铁粉生锈。