题目内容
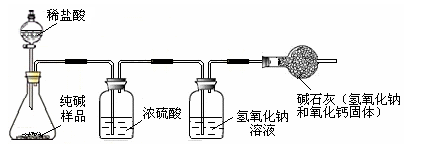
为了测定含杂质的氧化铁(杂质不参加反应)样品中氧化铁的质量分数,某同学称取该样品10 g,并用下图所示的装置进行实验,
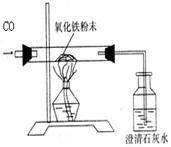
得到如下两组数据:
试回答:
(1)①你认为,应当选择 组的数据来计算样品中的氧化铁的质量分数,请写出具体解题过程。
②请解释你不选另一组数据进行计算的原因
。
(2)这位同学所用装置的不足之处是 。

得到如下两组数据:
| | 反应前 | 氧化铁完全反应后 |
| A组 | 玻璃管和样品的质量43.7 g | 玻璃管和固体物质的质量41.3 g |
| B组 | 广口瓶和澄清石灰水的质量180 g | 广口瓶和瓶内物质的质量186.2 g |
试回答:
(1)①你认为,应当选择 组的数据来计算样品中的氧化铁的质量分数,请写出具体解题过程。
②请解释你不选另一组数据进行计算的原因
。
(2)这位同学所用装置的不足之处是 。
(1) ① A 80%
②广口瓶敞口放置,所以广口瓶中质量变化除了生成二氧化碳外,还受外部空气的影响,(或者氢氧化钙溶液吸收生成二氧化碳不完全。)
(2)缺少尾气回收装置。
②广口瓶敞口放置,所以广口瓶中质量变化除了生成二氧化碳外,还受外部空气的影响,(或者氢氧化钙溶液吸收生成二氧化碳不完全。)
(2)缺少尾气回收装置。
试题分析:(1)①应该用A组数据计算,由于玻璃管中的氧化铁被CO还原,生成了铁,故玻璃管内固体的质量会变小,且减少的质量,即为参加反应的氧化铁中氧元素的质量,据此进行计算即可。
根据题意,反应前玻璃管和固体样品的质量是43.7g,反应结束后玻璃管和固体样品的质量是41.3g,即固体质量减少2.4g,也就是参加反应的氧化铁中氧元素的质量为2.4g;
则氧化铁的质量为=2.4g÷
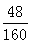 =8g,
=8g,所以,样品中的氧化铁的质量分数=
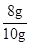 ×100% = 80%。
×100% = 80%。②由于广口瓶敞口放置,故广口瓶中的氢氧化钙溶液会与空气中的二氧化碳反应,故其质量的变化,可能由于受外部空气的影响而变大;当然,由于不确定氢氧化钙溶液是否足量,故无法确定反应过程中生成的二氧化碳是否被完全吸收完,也就不能确定生成的二氧化碳的质量,所以无法计算,故不选择B组数据进行计算。
(2)由于CO有毒,若直接排入空气中,会对空气造成污染,故需尾气处理,而实验装置中就缺少尾气回收装置。
点评:解答本题的关键是,要能将质量守恒定律的元素守恒思想,运用到解题过程中,结合还原反应的特征,判断出固体质量的减少量为氧化铁被夺去的氧元素的质量;此外,关于数据的选择,要注意不要忽略氢氧化钙微溶这个隐含条件,否则容易出错。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目