题目内容
实验室有一瓶新配制的稀盐酸(HCl气体溶于水得到的混合物为稀盐酸),其标签的部分内容如图所示。

(1)计算该稀盐酸中氯元素的质量分数。
(2)某实验小组用这种稀盐酸测定某石灰石样品中碳酸钙的质量分数,实验过程是:称取10g石灰石样品研成粉末,向其中加入7.3%的稀盐酸,产生二氧化碳的质量与加入盐酸的质量关系如图所示。(假设样品中的杂质都不和盐酸反应)计算石灰石样品中碳酸钙的质量分数。

(1)计算该稀盐酸中氯元素的质量分数。
(2)某实验小组用这种稀盐酸测定某石灰石样品中碳酸钙的质量分数,实验过程是:称取10g石灰石样品研成粉末,向其中加入7.3%的稀盐酸,产生二氧化碳的质量与加入盐酸的质量关系如图所示。(假设样品中的杂质都不和盐酸反应)计算石灰石样品中碳酸钙的质量分数。

(1)7.1%;(2)80%
试题分析:(1)要计算该稀盐酸中氯元素的质量分数,就要先计算出HCl中Cl元素的质量分数,再利用稀盐酸中HCl的质量分数,计算出稀盐酸中氯元素的质量分数。
故该稀盐酸中氯元素的质量分数=
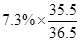 ×100%=7.1%
×100%=7.1%(2)根据题意,石灰石样品与稀盐酸反应,生成氯化钙、水和二氧化碳,故反应的化学方程式为CaCO3+ 2HCl=CaCl2+H2O+CO2↑,再结合图象可知,当石灰石样品完全反应时,生成的二氧化碳质量为3.52g,利用化学方程式中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量。
解,设石灰石样品中碳酸钙的质量为x
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 44
x 3.52g
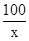 =
=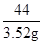
解得,x ="8g"
所以,石灰石样品中碳酸钙的质量分数=
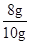 ×100%=80%
×100%=80% 答:石灰石样品中碳酸钙的质量分数是80%
点评:此题是关于化学方程式的计算题,要求学生有较强的识图能力和数据分析能力,解题的关键是根据图像找出恰好完全反应时,生成的二氧化碳气体的质量,再利用相关的化学反应,并依据已知量对未知的应求量进行求解计算即可。

练习册系列答案
相关题目



 Si+ 4HCl。请计算要获得56g硅(Si),至少需要氢气多少克?
Si+ 4HCl。请计算要获得56g硅(Si),至少需要氢气多少克?