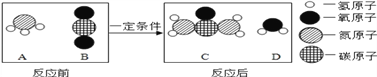
题目内容
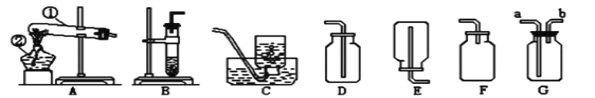
【题目】实验室制取某些气体所用的装置如图所示,请回答:
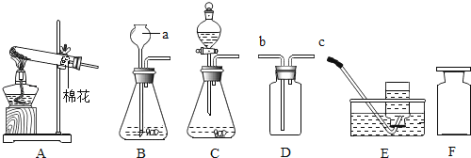
(1)图中标号a的仪器名称是__。
(2)实验室用A装置制取氧气,反应的化学方程式是____。
(3)乙炔(C2H2)是一种可燃性气体,已知实验室可用块状电石和水在常温下反应制取,该反应非常剧烈,则制取乙炔气体的发生装置最好选择__(填字母)。
(4)下列CO2的制备装置中,能起到“随开随制,随关随停”效果的是__(填序号)。
【答案】长颈漏斗 2KMnO4![]() K2MnO4+MnO2+O2↑ C ①③
K2MnO4+MnO2+O2↑ C ①③
【解析】
(1)图中标号a的仪器名称是长颈漏斗;故填:长颈漏斗
(2)可用装置A来进行的实验是固固加热型,且试管口塞有棉花,因此实验室加热高锰酸钾来制取氧气可选用A装置制取氧,其反应的化学方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑;故填:2KMnO4
K2MnO4+MnO2+O2↑;故填:2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)根据实验室可用块状电石和水在常温下反应制取,可知是固液不加热型,由于该反应非常剧烈,可知需要选择能控制反应速率的发生装置,因此制取乙炔气体的发生装置最好选择C;故填:C
(4)①用弹簧夹夹住橡胶管时气体排不出去,球形瓶中的气体压强变大,从而迫使稀盐酸从干燥管中排除并与大理石分离,反应停止;放开弹簧夹时,稀盐酸进入干燥管,并和烧杯中的液面相平同时与大理石接触,发生化学反应。所以该装置可以通过控制弹簧夹来达到使盐酸和大理石接触和分离,从而控制反应的发生和停止,故符合题意;
②国体放在大试管中酸放在小试管中,酸和固体不能分离,故无法控制反应发生和停止,故不符合题意;
③该装置将固体放于铜网上,铜网放入液体,反应生成气体,将铜网拉出,固液分离,反应停止,故符合题意;
④大理石放于隔板上,通过长颈漏斗添加液体,长颈漏斗下端在液面以上,没有形成液封,装置漏气,即使夹上弹簧夹液体也无法压入长颈漏斗,故无法控制反应的发生和停止,故不符合题意;故填:①③

 53天天练系列答案
53天天练系列答案【题目】下面有关氢氧化钠溶液的配制,请完成:
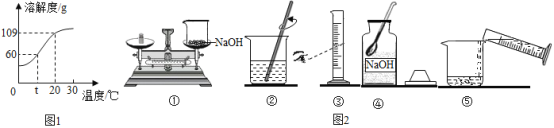
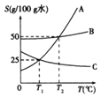
(1)氢氧化钠的溶解度曲线如1图,则:
①t℃时氢氧化钠溶解度是_____;
②20℃时,小惠向100g的水中加入120g氢氧化钠,发现溶液的温度_____(填“上升”“下降”或“不变”),氢氧化钠全部溶解。过一段时间恢复到20℃时,又有部分氢氧化钠晶体析出,所形成的溶液是_____溶液(填“饱和”或“不饱和”),析出的晶体质量是_____g;
③配制100g 10%的氢氧化钠溶液,所需水的质量是_____g。
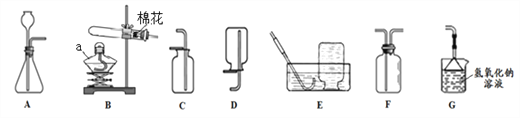
(2)如图2是她配置氢氧化钠溶液的实验操作示意图。
①实验操作示意图中的操作错误的是_____(填编号);
②纠错后用上述图示的序号表示配置溶液的操作顺序:_____。
(3)某研究小组对自动充气气球(示意图如下图1)进行下列探究。
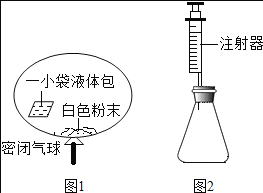
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
①为检验气体是二氧化碳,可选用_____(填试剂名称)。
探究一:液体包内溶液酸碱性的探究
②室温时,用pH试纸测得溶液的pH=3,则该溶液呈_____性。
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
[设计并进行实验]
③将少量白色粉末放入足量水中搅拌,固体全部溶解,说明甲同学的猜想_____(填“正确”或“不正确”)、
④室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
a | 碳酸氢钠 | 0.10 | V1 |
b | 碳酸钠 | x | V2 |
c | 白色粉末 | 0.10 | V1 |
实验a的化学方程式为_____;表中x=_____;V1_____V2(填“>”、“<”或“=”)、
[分析并得出结论]
⑤白色粉末是_____。
【题目】小明同学在做铝和稀盐酸反应时无意中加入几滴硫酸铜溶液,发现铝片表面产生气泡速率明显增快,对此他产生了兴趣。
(提出问题)硫酸铜溶液是不是此反应的催化剂?硫酸铜溶液的体积对此实验有影响吗?
(设计并实验)室温下,小明将过量、表面积相同已打磨的铝片分别加入到6份30mL10%稀盐酸中,并在每份中加入不同体积的硫酸铜饱和溶液,记录获得相同体积氢气的时间,从而确定产生氢气的速率。
实验混合溶液 | 1 | 2 | 3 | 4 | 5 | 6 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
水/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
(1)上述表格中V=______________。
(2)写出铝和稀盐酸反应的化学方程式:______________。
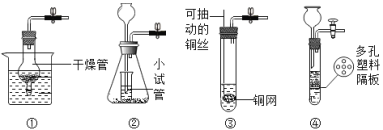
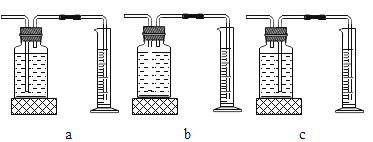
(3)定量收集氢气体积可用如图________(填写字母序号)装置。
(实验现象)随着硫酸铜溶液体积的增加,产生氢气的速率先加快后明显减慢,且铝片表面附着的红色物质逐渐增加。
(结论与解释)
(4)随着硫酸铜溶液体积的增加,反应速率明显变慢可能的原因是___
(5)根据实验现象小明认为硫酸铜溶液不是此反应的催化剂,其原因是___
(实验反思)加速铝和稀盐酸反应速率还可以采取的措施是___(写出一点)
(注意:若正确回答下列各题奖励4分,化学总分不超过60分)
(实验拓展)根据上述实验,小明认为是盐中的金属离子影响了铝和稀盐酸的反应速率;为了研究不同金属离子对反应的影响,小明同学继续实验,取过量表面积相同的铝片和30mL10%稀盐酸混合后加入不同的盐溶液,实验现象如表(加号越多,代表反应速率越快):
实验1 | 实验2 | 实验3 | 实验4 | ||
加入试剂0.5mL | 水 | 5%NaCl溶液 | 5%Mg2(NO)3溶液 | 5%FeSO4溶液 | 5%CuSO4溶液 |
产生气泡速率 | + | + | + | ++ | +++ |
(6)如表中,用水进行实验的目的是_________;
(7)上述实验设计存有缺陷,该缺陷是;改进实验后,仍符合上表中的实验现象,可得到的结论是:①______________;②______________.