题目内容
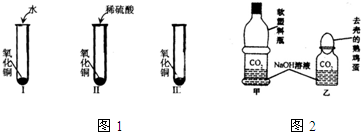
 氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究活动.(1)你提出的假设是 .
(2)通过实验I可以证明 .
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅲ中应该加入 .
(4)探究结果为 .你认为除实验Ⅱ和Ⅲ所用试剂外,还能够溶解氧化铜的一种常见物质是 .
【答案】分析:由金属氧化物能与酸溶液反应生成水,不难得出氧化铜能溶于稀硫酸,是因为硫酸溶液中有氢离子的作用,抓住这一关键点就不难形成正确的思路.
解答:解:(1)假设无所谓对错,故答案为:使氧化铜溶解的是氢离子(或水分子或硫酸根离子)
(2)由于真正使氧化铜溶解的是氢离子,因此在实验1中不会看到明显的实验现象,故答案为:水分子不能使氧化铜溶解,
(3)因为在1、2中已经有了水分子和氢离子,在实验3中应该加入一种含有硫酸根离子的溶液,硫酸钠(或硫酸钾等)
(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子,只有含有大量氢离子的溶液才可以和氧化铜反应,使之溶解,故答案为:是H+使氧化铜溶解,稀盐酸(或稀硝酸等)
点评:主要考查了酸溶液和氧化铜反应的本质,是溶液中的氢离子和氧化铜反应的结果,培养学生分析问题、解决问题的能力.
解答:解:(1)假设无所谓对错,故答案为:使氧化铜溶解的是氢离子(或水分子或硫酸根离子)
(2)由于真正使氧化铜溶解的是氢离子,因此在实验1中不会看到明显的实验现象,故答案为:水分子不能使氧化铜溶解,
(3)因为在1、2中已经有了水分子和氢离子,在实验3中应该加入一种含有硫酸根离子的溶液,硫酸钠(或硫酸钾等)
(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子,只有含有大量氢离子的溶液才可以和氧化铜反应,使之溶解,故答案为:是H+使氧化铜溶解,稀盐酸(或稀硝酸等)
点评:主要考查了酸溶液和氧化铜反应的本质,是溶液中的氢离子和氧化铜反应的结果,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
28、氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动. 21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动.
21、氧化铜是一种黑色固体,可溶于稀硫酸:某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图I、II、III三个实验完成这次探究活动. 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸中的哪种粒子(H+、SO42-、H2O)能使氧化铜溶解,请你帮他通过下图中的三个实验完成探究活动.