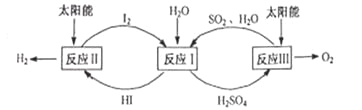
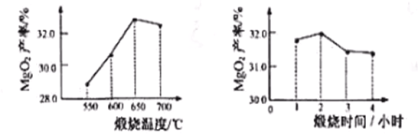
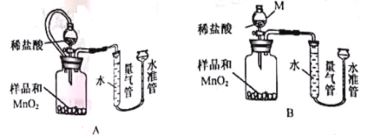
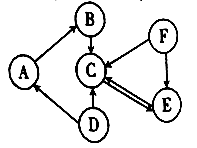
题目内容
【题目】下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
【答案】A
【解析】A选项溶液时均一稳定的混合物是正确的叙述;B选项是错误的叙述,形成溶液的溶质都是固体是错误的叙述,如盐酸的溶质为氯化氢气体;C选项是错误的叙述,同一溶质在相同的温度下,饱和溶液一定比不饱和溶液浓;D选项是错误的叙述,因为微粒之间有间隔,故溶液的体积不等于溶质和溶剂体积之和;答案选择A

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目