题目内容
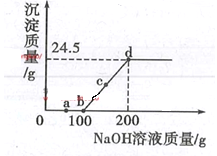
【题目】有一道作业题:取100 g溶质质量分数为8%的氢氧化钠溶液倒入烧杯中,向其中加入100 g 19.6%的稀硫酸,充分反应后,求所得溶液中硫酸钠的质量分数。批改时老师发现两种答案:
结果编号 | ① | ② |
计算结果 | 14.2% | 7.1% |
请你分析并回答问题:
(1)氢氧化钠与硫酸反应时的质量比为________。
(2)请判断哪个结果是正确的______。(写出计算过程)
(3)反应前后钠元素的质量________(填“增大”“减小”或“不变”)。
【答案】40∶49 7.1% 不变
【解析】
(1)氢氧化钠与硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O ,根据化学方程式可知,氢氧化钠与硫酸反应时的质量比=(2×40):98=40∶49;
(2)100g溶质质量分数为8%的氢氧化钠溶液中氢氧化钠的质量为8g,根据(1)可知,恰好完全反应消耗的硫酸的质量为9.8g,而100g19.6%的稀硫酸中溶质的质量为19.6g,所以硫酸过量,应该根据氢氧化钠求算硫酸钠的质量。
设所得溶液中硫酸钠的质量为x。

![]() x=14.2 g
x=14.2 g
所得溶液中硫酸钠的质量分数=![]() ;
;
答:计算结果②正确。
(3)根据质量守恒定律可知,反应前后钠元素的质量不变。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】铜片在空气中久置表面会变绿。某小组同学设计并进行实验,探究铜变绿的条件。
(查阅资料)(1)、铜绿的成分是碱式碳酸铜![]() ,碱式碳酸铜能够与盐酸反应。
,碱式碳酸铜能够与盐酸反应。
(2)、浓硫酸具有吸水性,可以作为一些气体的干燥剂。
(猜想与假设)常温下,铜片变绿可能与![]() 、
、![]() 、水蒸气有关。
、水蒸气有关。
(进行实验)利用下图1装置分别制取并收集气体于试管中,制取气体原理及收集气体等操作见下表。将收集好的气体,用图2所示装置进行4个实验,通过控制与铜片接触的物质,进行实验并持续观察实验现象。
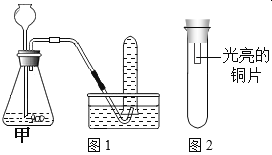
编号 | 主要实验操作 | 实验现象 |
1 | 甲中盛有过氧化氢溶液和二氧化锰,收集一试管气体 | 铜片始终无明显变化 |
2 | 甲中盛有大理石和稀盐酸,收集一试管气体 | 铜片始终无明显变化 |
3 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体 | 一段时间后铜片变绿 |
4 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体,并向气体中加入适量浓硫酸 | 铜片始终无明显变化 |
(解释与结论)
(1)实验1的目的是验证______。
(2)实验2制取气体反应的化学方程式为______。
(3)得出“铜片变绿一定与![]() 有关”的结论,依据的两个实验是______
有关”的结论,依据的两个实验是______![]() 填编号
填编号![]() 。
。
(4)实验4中,试管内的气体主要含有______。
(5)上述实验可推知,铜片变绿的条件是______。
(讨论与交流)
(6)同学们猜想碱式碳酸铜与盐酸反应有二氧化碳生成,证明此猜想所需试剂是______。
【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。