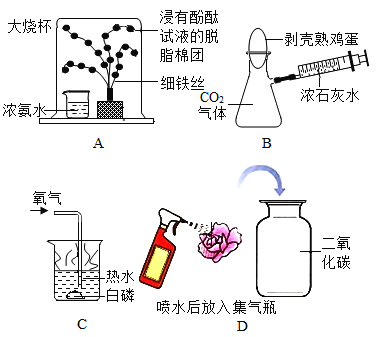
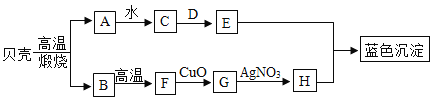
题目内容
【题目】将铜、氧化铜、氢氧化铜混合粉末25g在加热条件下用氢气还原,反应完全后,测得有0.5g氢气参加了反应,同时有6.3g水生成。试计算该混合物中铜、氧化铜、氢氧化铜各多少克。
【答案】铜、氧化铜、氢氧化铜质量分别为3.2g、12g、9.8g
【解析】
水中氢元素质量=水的质量×水中氢元素质量分数=6.3g×![]() =0.7g,而参与反应的氢气质量为0.5g,所以根据氢元素质量守恒,可知氢氧化铜中氢元素的质量=0.7g-0.5g=0.2g。
=0.7g,而参与反应的氢气质量为0.5g,所以根据氢元素质量守恒,可知氢氧化铜中氢元素的质量=0.7g-0.5g=0.2g。
设氢氧化铜的质量为m,
m×氢氧化铜中氢元素质量分数=0.2g
m×![]() =0.2g m=9.8g,所以氢氧化铜的质量为9.8g;
=0.2g m=9.8g,所以氢氧化铜的质量为9.8g;
氢氧化铜在加热条件下可以分解生成氧化铜和水,因此氢气还原的氧化铜中有氢氧化铜生成的氧化铜,设其质量为y,
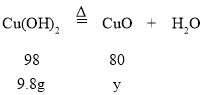
![]()
y=8g
设氢气反应消耗的氧化铜质量为x,
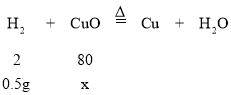
![]()
x=20g
所以原样品中氧化铜质量=x-y=20g-8g=12g,剩余原样品中铜的质量=25g-12g-9.8g=3.2g。
答:该混合物中铜、氧化铜、氢氧化铜质量分别为3.2g、12g、9.8g。
故答案为:铜、氧化铜和氢氧化铜质量分别为3.2g、12g、9.8g。

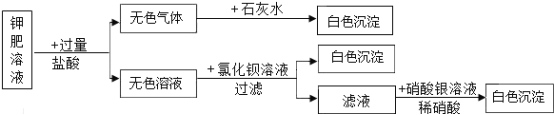
【题目】草木灰是一种农家肥料,其主要成分是碳酸钾(K2CO3 ),某兴趣小组同学对草木灰的成分产生兴趣,进行了如下实验探究。
(提出问题)草木灰中含有碳酸钾吗?
(查阅资料)①碳酸钾呈无色晶体状或白色颗粒状固体,易溶于水,水溶液呈碱性。
②钾离子的检验方法:将铂丝蘸稀盐酸在酒精灯火焰上灼烧至无色,蘸取试样在酒精灯火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若火焰呈紫色则含有钾离子。
(进行实验)
取少量草木灰放入一只洁净烧杯中,加入足量水充分搅拌,静置,待用。
任务一:将铂丝蘸稀盐酸在酒精灯火焰上灼烧至无色,蘸取烧杯中上层清液少许在酒精灯火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,火焰呈紫色,则溶液中含有__________(填离子符号)。
任务二:下面为同学们设计的检验 CO32- 实验方案:
方案 1:甲同学设计了如下实验方案
实验步骤 | 实验现象 | 实验结论 |
取上述烧杯中少量上层清液于试管中,滴加足量稀盐酸 | ___________ | 溶液中含有 CO32- |
乙同学对甲同学的方案提出质疑:认为要证明 CO32- 存在,还需进一步证明_________________,检验的化学反应方程式为_______________。
方案 2:丙同学设计了如下方案。用pH试纸测定上层溶液的酸碱性,pH>7,溶液中含有CO32-,具体操作方法是____________。
丁同学对上述方案产生质疑:认为溶液 pH>7,草木灰中可能含有氢氧化钾。同学们针对丁同学的质疑又进行了如下实验:取少量上层溶液于试管中,滴加足量 CaCl2 溶液,充分反应后过滤,向滤液中滴几滴_______________溶液。滴加足量 CaCl2 溶液的作用是_______________。
(反思提高)草木灰作为肥料,适宜在____________(填“酸”“碱”或“中”)性土壤中施用。
【题目】双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。下图是用水吸收下列某气体时情形,根据下列附表判断由左方进入的被吸收气体应是_____。
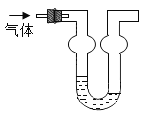
附:室温下四种气体的溶解度表
气体 | Cl2 | HCl | H2S | CO2 |
1体积水约能吸收气体体积数 | 2 | 500 | 2.6 | 1 |
【题目】有一道作业题:取100 g溶质质量分数为8%的氢氧化钠溶液倒入烧杯中,向其中加入100 g 19.6%的稀硫酸,充分反应后,求所得溶液中硫酸钠的质量分数。批改时老师发现两种答案:
结果编号 | ① | ② |
计算结果 | 14.2% | 7.1% |
请你分析并回答问题:
(1)氢氧化钠与硫酸反应时的质量比为________。
(2)请判断哪个结果是正确的______。(写出计算过程)
(3)反应前后钠元素的质量________(填“增大”“减小”或“不变”)。