题目内容
【题目】下列是初中化学常见的实验。请回答下列问题
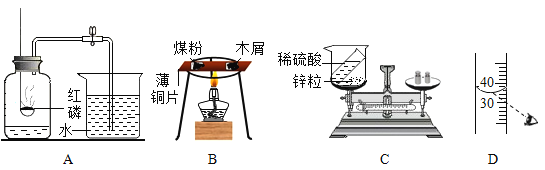
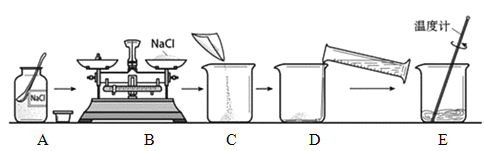
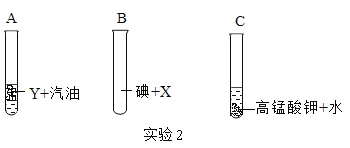
(1)图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是_____(答出一条即可)。
(2)图B所示实验观察到木屑先燃烧,燃烧的顺序说明燃烧的条件之一是_____。
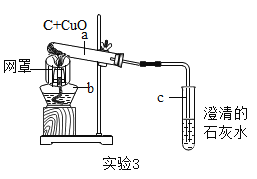
(3)图C所示实验不能验证质量守恒定律的原因是_____。
(4)配制一定质量分数的氯化钠溶液,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质的质量分数_____(填“偏大”、“偏小”或“不变”)。
【答案】红磷的量不足(或装置漏气或没有冷却到室温就打开弹簧夹) 温度达到了可燃物的着火点 装置不密闭,锌粒和稀硫酸反应生成的氢气逸散到空气中 偏小
【解析】
(1)根据探究空气中氧气含量的实验注意事项进行分析;
(2)根据燃烧的我歌今与君殊科进行分析;
(3)根据质量守恒定律定律的定义进行分析;
(4)根据配制溶液时的注意事项进行分析。
(1)图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是:红磷的量不足(或装置漏气或没有冷却到室温就打开弹簧夹);
(2)煤粉和木屑都是可燃物,都与氧气接触,木屑先燃烧是因为温度先达到了木屑的着火点;
(3)参加反应的各物质的质量总和等于反应后生成的各物质的质量总和;图C所示实验不能验证质量守恒定律的原因是:装置不密闭,锌粒和稀硫酸反应生成的氢气逸散到空气中;
(4)用量筒量取液体时,仰视读数,使实际量取液体的体积比要量取的液体体积偏大,配制溶液溶质的质量分数偏小。

 阅读快车系列答案
阅读快车系列答案【题目】为了对KCl样品(含少量KNO3)进行分组分析,甲、乙、丙三位同学分别进行实验,他们实验数据如下表,请仔细观察和分析数据回答问题:(已知KCl+AgNO3=KNO3+AgCl↓)
甲 | 乙 | 丙 | |
所取固体样品的质量/g | 20 | 10 | 10 |
加入AgNO3溶液的质量/g | 100 | 100 | 150 |
反应后所得沉淀的质量/g | 14.35 | 14.35 | 14.35 |
⑴三位同学中_____同学所用KCl和AgNO3恰好完全反应(填编号)。
⑵样品中KCl的质量分数是多少?_____
⑶三位同学分别把反应后的溶液过滤,哪一位同学所得的溶液是只含有一种溶质的溶液?_______此溶液中溶质的质量分数是多少?_____