题目内容
把10g铁和铜的混合物放入盛有47.3g稀硫酸的烧杯中,恰好完全反应,烧杯中物质的总质量比反应前铁和铜的混合物与稀硫酸的总质量减少了0.10g
(1)原混合物中铜的质量?
(2)反应后所得溶液中溶质质量分数?
(2)反应后所得溶液中溶质质量分数?
(1)原混合物中铜的质量为7.2g;
(2)反应后所得溶液中溶质质量分数为15.2%
生成的氢气的质量为0.10g,设参加反应的铁的质量是x,生成的硫酸亚铁的质量是y
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.10g
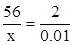
x=2.8g

y=7.6g
(1)原混合物中铜的质量为:10g﹣2.8g=7.2g;
(2)反应后所得溶液中溶质质量分数为: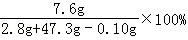 =15.2%
=15.2%
(2)反应后所得溶液中溶质质量分数为15.2%
生成的氢气的质量为0.10g,设参加反应的铁的质量是x,生成的硫酸亚铁的质量是y
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.10g
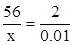
x=2.8g

y=7.6g
(1)原混合物中铜的质量为:10g﹣2.8g=7.2g;
(2)反应后所得溶液中溶质质量分数为:
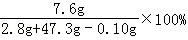 =15.2%
=15.2%
练习册系列答案
相关题目
 CaO+ CO2↑
CaO+ CO2↑