题目内容
【题目】(14分)归纳总结是学习化学的重要方法。请回答下列问题:
(1)“一碳化学”是以一个分子中只含一个碳原子的化合物为原料合成一系列化工原料和燃料的化学。
①甲烷的化学式是
②炼铁时用一氧化碳还原氧化铁的化学方程式为
③在催化剂存在的条件下,用CO和H2合成甲醇(CH4O),写出反应的化学方程式为
(2)酸碱盐之间能相互反应。碱与盐之间若有气体生成,反应就能发生,请写出该气体的化学式 。酸与盐之间能发生反应,分析有图,写出反应的化学方程式 。
(3)金属活动顺序有重要的应用。
①将一段锌片插入到CuSO4溶液中,观察到明显的现象,反应的化学方程式 。
②金属分别与水、水蒸气的反应的情况如下表:
物质 | 镁与冷水 | 铁与冷水 | 铁与水蒸气 | 铜与冷水 | 铜与水蒸气 |
反应情况 | 缓慢反应 | 不反应 | 能反应 | 不反应 | 不反应 |
根据金属活动性顺序和表中的信息,推断“镁与水蒸气”的反应合理的是 (填写代号)
A 不反应 B 缓慢反应 C 比镁与冷水反应快 D 比铁于水蒸气反应快
③已知在加热的条件下铁与水蒸气反应生成四氧化三铁和氢气,该反应的化学方程式为
。
【答案】(1) ①CH4(1分)
②3CO+Fe2O3![]() 2Fe+3CO2(2分)
2Fe+3CO2(2分)
(2)NH3,(1分) Ba(NO3)2+H2SO4="=BaSO4↓+2HNO3 "
(3)①Zn+CuSO4==Cu+ZnSO4;②C、D
3Fe+4H2O![]() Fe3O4+4H2↑
Fe3O4+4H2↑
【解析】
(1) ①甲烷的化学式为CH4,需熟记。②炼铁时用一氧化碳还原氧化铁的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2,需熟记。
2Fe+3CO2,需熟记。
(2)碱与盐之间若有气体生成,只能是铵盐和碱反应生成氨气,所以该气体的化学式是NH3,图中表示的物质是硫酸和硝酸钡,所以其反应方程式为Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
(3)①,锌能与硫酸铜反应,其反应方程式为Zn+CuSO4==Cu+ZnSO4
②由铁、铜和冷水、水蒸气反应情况对比可以看出金属与水蒸气反应比冷水反应要快,镁的活动性比铁强,铁能与水蒸气反应,所以镁也能与水蒸气反应,故选C、D,
③反应物生成物已经给出,即可写出反应方程式为:3Fe+4H2O![]() Fe3O4+4H2↑。
Fe3O4+4H2↑。
(3)根据所给物质即可写出化学反应方程式,6 CO(NH2)2=C3H6N6+6NH3↑+3CO2↑

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】学习了在过氧化氢分解制氧气的反应中二氧化锰的作用后,石建和秦思发现红砖粉末(主要含有氧化铁)也会对过氧化氢分解制氧气产生影响。
(提出问题)红砖粉末在过氧化氢分解制氧气的反应中起什么作用呢?
(猜想与假设)石建的猜想:红砖粉末在过氧化氢分解制氧气的反应中不起催化作用;
秦思的猜想:(1)____________。
(实验探究)..为验证猜想,进行下列实验活动。
实验序号 | (实验过程) | (收集证据) | (解释与结论) |
I | 实验前称量红砖粉末的质量 | 质量为mg | |
II |
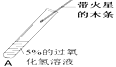
| 伸入A中的带火星的木条不能复燃 | 是因为 (2)_____________ |
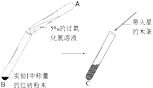
III | 将I称量的红砖粉末放入B中,
| 观察到C中的(3)_____ 。 | 用符号表达式解释C的 液体中产生现象的原因是(4)____________________。 与II对比,证明红砖粉末 (5)_________ 。 |
IV | 待试管C中没有现象时,重新加入过氧化氢溶液,伸入带火星的木条。重复此操作 | 均观察到与III中相同的实验现象 | 证明化学反应前后红砖粉末的(6)_______ 。 |
V | 反复实验后,经过相应的操作,再次称量红砖粉末的质量 | 质量为mg | 证明化学反应前后红砖粉末的(7)___________。 |
(总结与反思)综合上述实验结论,可确定(8)_________的猜想正确。实验室中用过氧化氢制氧气时使用二氧化锰而不是红砖粉末,由此你得出的一条结论或提出的一个有探究价值的问题是(9)___________。