题目内容
【题目】配制20%的NaCl溶液100g。
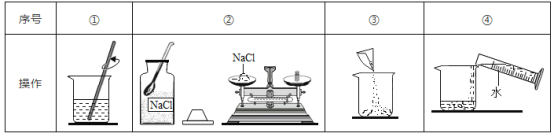
(1)①中玻璃棒的作用是_____。
(2)用托盘天平称取所需的氯化钠,发现指针向右偏转,接下来的操作是_____(填字母序号)。
A 继续添加氯化钠 B 减少砝码
(3)用量筒量取水的体积为_____mL(ρ水≈1g/cm3)。
(4)该实验的正确操作顺序为_____(填数字序号)。
【答案】搅拌,加快溶解速率 A 80 ②③④①
【解析】
(1)溶解时玻璃棒的用途是搅拌,加快溶解速率;
(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加固体物质;若发现指针向右偏转,说明固体物质药品的质量小于砝码的质量,故应继续向左盘添加氯化钠,直至天平平衡。
(3)溶质质量=溶液质量×溶质的质量分数,配制20%的NaCl溶液100g,需氯化钠的质量=100g×20%=20g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣20g=80g(合80mL)。
(4)配制20%的NaCl溶液100g,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解,故该实验的正确操作顺序为②③④①。
故答案为:(1)搅拌,加快溶解速率;(2)A;(3)80;(4)②③④①。

【题目】(1)如表是某种常见金属的部分性质:
颜色、状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
银白色固体 | 较软 | 2.70g/cm3 | 660.4℃ | 良好 | 良好 | 良好 |
将该金属投入稀盐酸中,可产生大量的无色气体。回答以下问题:
①试推断该金属可能的一种用途_____;
②该金属的活动性比铜_____(填“强”或“弱”);
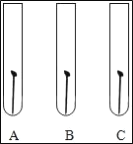
(2)某学生想探究铁生锈是否必须同时有空气和水,他将干净的铁钉放入A、B、C三支干净的试管中,再各加入某些物质或用品进行研究。
①在如图的每支试管中画出并标明所加的物质或用品。
②一周后,编号为_____的试管中铁钉最易生锈。
③写出一氧化碳在高温条件下把铁从赤铁矿(主要成分是氧化铁)里还原出来的化学方程式:_____。
④铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,其原因是_____。
⑤某炼铁日产含碳3%的生铁310t,问该厂每天至少需要含氧化铁80%的赤铁矿石_____吨。
【题目】(14分)归纳总结是学习化学的重要方法。请回答下列问题:
(1)“一碳化学”是以一个分子中只含一个碳原子的化合物为原料合成一系列化工原料和燃料的化学。
①甲烷的化学式是
②炼铁时用一氧化碳还原氧化铁的化学方程式为
③在催化剂存在的条件下,用CO和H2合成甲醇(CH4O),写出反应的化学方程式为
(2)酸碱盐之间能相互反应。碱与盐之间若有气体生成,反应就能发生,请写出该气体的化学式 。酸与盐之间能发生反应,分析有图,写出反应的化学方程式 。
(3)金属活动顺序有重要的应用。
①将一段锌片插入到CuSO4溶液中,观察到明显的现象,反应的化学方程式 。
②金属分别与水、水蒸气的反应的情况如下表:
物质 | 镁与冷水 | 铁与冷水 | 铁与水蒸气 | 铜与冷水 | 铜与水蒸气 |
反应情况 | 缓慢反应 | 不反应 | 能反应 | 不反应 | 不反应 |
根据金属活动性顺序和表中的信息,推断“镁与水蒸气”的反应合理的是 (填写代号)
A 不反应 B 缓慢反应 C 比镁与冷水反应快 D 比铁于水蒸气反应快
③已知在加热的条件下铁与水蒸气反应生成四氧化三铁和氢气,该反应的化学方程式为
。
【题目】某化学兴趣小组对“NaOH溶液与稀硫酸是否恰好完全反应”进行探究.请你参与他们的探究活动,并回答有关问题.
(实验探究)
(1)方案一:某同学按如图所示的方法先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红色.然后慢慢滴入稀硫酸,边滴边振荡,直至溶液恰好变为______色,证明NaOH溶液与稀硫酸恰好完全反应.
![]()
①请指出如图操作中的错误______.
②写出NaOH溶液与稀硫酸反应的化学方程式______.
(2)方案二:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀硫酸,振荡后加入镁条 | 若 ______ | 稀硫酸过量 |
若没有现象 | NaOH溶液与稀硫酸恰好完全反应 |
(实验反思)
(3)方案一在滴入稀硫酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是______(写出一条即可).
(4)有同学提出方案二不能证明NaOH溶液与稀硫酸恰好完全反应,其原因是______.为此,还需要选择______(填一种试剂),再进行实验即可.
(拓展应用)
(5)请举一例说明中和反应在生产生活中的应用______.