题目内容
【题目】(1)化肥硝酸铵化学式为NH4NO3,试回答:
①硝酸铵中氮元素的化合价依次是 , 。
②硝酸铵分子中所含的氮、氢、氧各种原子的个数比是 。
③硝酸铵由 种元素组成。
④硝酸铵中氮元素的质量分数为 。
⑤市场上销售的某种化肥中,硝酸铵的质量分数为80%,则100克这种化肥中含有氮元素多少克?请写出解题过程。
(2)现有氯酸钾和二氧化锰的混合物共26.5g,待反应不再有气体生成后,将试管冷却,得到剩余固体16.9g,求:①制取氧气的质量。 ②剩余固体中含有的各物质的质量为多少克?
【答案】(1) -3、+5 2:4:3 三 35% 100g x 80% x35%=28g
(2)9.6g (2)二氧化锰2g,氯化钾14.9g
【解析】
试题分析:解(1)根据铵根、硝酸根的化合价可知①硝酸铵中氮元素的化合价依次是-3、+5;②硝酸铵分子中所含的氮、氢、氧各种原子的个数比为元素符号右下角的角标之比为:2:4:3 ;有元素符号的种类可知③硝酸铵由三种元素;④硝酸铵中氮元素的质量分数为28/80×100%=35%;⑤市场上销售的某种化肥中,硝酸铵的质量分数为80%,则100克这种化肥中含有氮元素为100g x 80% x35%=28g。
(2)(1)待反应至不再有气体生成后,制取氧气的质量=26.5g-16.9g=9.6g;
设原混合物中氯化钾的质量为X:
2KClO3![]() 2KCl + 3O2 ↑
2KCl + 3O2 ↑
149 96
X 9.6g
149/96=X/9.6g X=14.9g
二氧化锰的质量为:16.9g-14.9g=2g
答:原混合物中氯化钾的质量为14.9 g.二氧化锰的质量为2g

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】水和溶液在生产、生活中起着十分重要的作用。
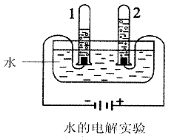
(1)下图是电解水实验装置。在实验过程中,试管1产生的气体是 ,写出水在通电条件下反应的化学方程式 。
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为
__ __。
(3)20℃时,氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液中溶质和溶剂的质量比为 。
(4)为了进行农业选种,现将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,需要加水的质量为 。
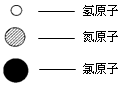
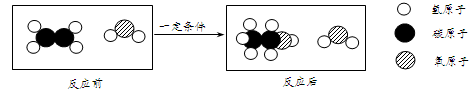
(5)自来水中通入少量氯气可以杀菌消毒,化工厂常用浓氨水检测氯气储存设备或者输气管是否有氯气泄漏。A、B、C、D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。
物质 | A | B | C | D |
|
化学式 | NH3 | Cl2 | N2 | ||
微观示意图 |
|
|
|
|
D的化学式为 。
若17 g A参加反应,则生成C的质量为 g。