题目内容
【题目】元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
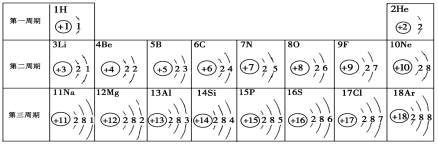
⑴第16号元素属于_______元素(填“金属”或“非金属”),它在化学反应中容易________(填“得”或“失”)电子;
⑵元素的化学性质与原子结构中的______________关系密切;一个水分子中有_____个原子核,氯离子的最外层有____个电子。
⑶在同一族中,各元素的原子结构呈现的规律有________________ (任写一点);
⑷研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
【答案】(1)非金属 得 (2)最外层电子数 ,3,8(3)最外层电子数相等或从上到下电子层数依次递增
(4)逐渐减小
【解析】
试题分析:(1)根据元素原子最外层电子数的特点:非金属元素的原子最外层电子的数目一般多于4,在化学反应中容易得到电子达到稳定结构,可知:第16号元素属于非金属元素;(2)根据元素的化学性质与原子核外的最外层电子数有密切关系:电子数少于四个的一般容易失去电子形成阳离子,电子数少于八个而多于或等于四个的一般容易得到电子形成阴离子,电子数为八个的化学性质一般稳定,不容易发生化学变化;进行解答;(3)根据在同一个族中,电子层数的变化或最外层电子数的特点等或从上到下核电荷数变化特点可知:电子层数递增,或最外层电子数相等,或从上到下核电荷数增大等;(4)依据题中信息从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.所以从11~17号元素原子半径变化规律是;逐渐减小。