��Ŀ����
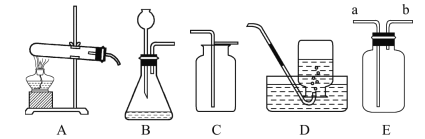
����Ŀ����������װ��ͼ���ش��й����⣺
(1)д��ʵ������H2O2��ȡ�����Ļ�ѧ����ʽ��_____��
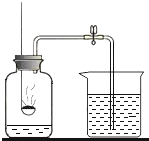
(2)���ø��������ȡ��������ѡ�õķ���װ����____(����ĸ���)��
(3)ָ��װ��B�еĴ���____��
(4)ʵ���ҳ���װ��C��D�ռ������⣬������Eװ���ռ�����������Eװ��װ��ˮ���ռ������壬Ӧ��___(����a������b��)��ͨ�����塣
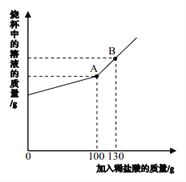
(5)����㣬��ȡ3.2g��������������Ҫ������ص�����Ϊ___g����Ҫ��������Ϊ30%�Ĺ���������Һ������Ϊ____g��
(6)ij��ѧ�Լ���˾���ۣ��������30.50Ԫ/kg��30%�Ĺ���������Һ21.70Ԫ/kg�����ʵ������������ɱ������濼�ǣ���_____�ķ�����ȡ��������(�������̼۸�ͣ������٣��ɺ��Բ���)�����ַ�������Ҫ�ŵ���_____��
���𰸡�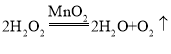 A ����©�����¶�û������Һ������ b 31.6 22.7 30%�Ĺ���������Һ ��ȡ��ͬ������������Ҫ�������������Һ�ȸ�����صļ۸�ͣ��ֽ���������ù���������ȡ��������Ҫ���ȣ��������
A ����©�����¶�û������Һ������ b 31.6 22.7 30%�Ĺ���������Һ ��ȡ��ͬ������������Ҫ�������������Һ�ȸ�����صļ۸�ͣ��ֽ���������ù���������ȡ��������Ҫ���ȣ��������
��������
(1)ʵ������Bװ����ȡ��������Ҫ���ȣ������ù��������ڶ��������������������·ֽ�����ˮ����������Ӧ�Ļ�ѧ����ʽΪ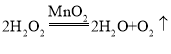 ��
��
(2)��������ڼ�����������������ء��������̺�������ʵ�����ø��������ȡ������Ҫ���ȣ�ѡ��̹̼����ͷ���װ�ã���ѡ�õķ���װ����Aװ�ã�
(3)��ͼ��ʾװ��B��Ϊ��ֹ����ӳ���©���ݳ�������©�����¶�Ӧ����Һ�����£�
(4)��ͼ��ʾ����Eװ��װ��ˮ���ռ������壬Ӧ�Ӷ̹ܽ���Ӧ��b��ͨ������
(5) ����ȡ3.2g��������������Ҫ������ص�����Ϊx����Ҫ��������Ϊ30%�Ĺ���������Һ������Ϊy�����У�
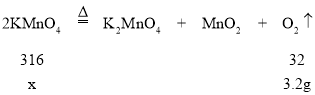
��![]() ���x=31.6g
���x=31.6g
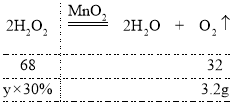
��![]() ���y��22.7g
���y��22.7g
����ȡ3.2g��������������Ҫ������ص�����Ϊ31.6g����Ҫ��������Ϊ30%�Ĺ���������Һ������Ϊ22.7g��
(6)������������30.50Ԫ/kg��30%�Ĺ���������Һ21.70Ԫ/kg����ϵڣ�5���ʵļ����֪�����ɵ����������������ĸ�����ص�������30%�Ĺ���������Һ���������Ҹ������ÿǧ�˵ĵ��۱�30%�Ĺ���������Һÿǧ�˵ĵ��۸ߣ������ø�������������ijɱ����ߣ�����ֽ���������ù���������ȡ��������Ҫ���ȣ�������㣬����30%�Ĺ���������Һ��ȡ�������á�

����Ŀ�����л�ѧ�У�����ѧϰ����ͼ���кͷ�Ӧ��ʵ����H++OH���TH2O����ͼ����������ʵ�ʲμӷ�Ӧ�����ӷ�������ʾ��Ӧ��ʽ�ӽ����ӷ���ʽ��

���ӷ���ʽ����дһ�㰴���²��裺����Na2SO4��BaCl2��ӦΪ����
��д��Na2SO4��BaCl2��Ӧ�Ļ�ѧ����ʽ�� ��
����������ˮ����������д��������ʽ�������ܵ����ʡ������ˮ�����û�ѧʽ��ʾ����������ʽ�ɸ�д�ɣ�2Na++SO42��+Ba2++2Cl���TBaSO4��+2Na++2Cl����
��ɾȥ����ʽ���߲��μӷ�Ӧ�����ӣ�Ba2++SO42���TBaSO4����
����鷽��ʽ���߸�Ԫ�ص�ԭ�Ӹ����͵�������Ƿ���ȡ�
��ش�
��1�����и����е����ӣ���pH=3��ˮ��Һ���ܴ���������� ��
A��Na+��Mg2+��Cl����SO4 2�� | B��Na+��K+��Cl����OH�� |
C��Na+��Cu2+��Cl����SO42�� | D��Na+��K+��Cl����CO32�� |
��2��д��ϡ�������ʯ��ʯ����������Ӧ�����ӷ���ʽ ��
��3��д��һ�������ӷ���ʽMg+2H+�TMg2++H2�����Ӧ�Ļ�ѧ����ʽ ��
��4���ᡢ�����ˮ��Һ�з����ĸ��ֽⷴӦʵ���Ͼ������ֻ���������Һ����������ӵķ�Ӧ��ֻҪ�߱��������������������� ���ɣ���Ӧ���ܷ�����