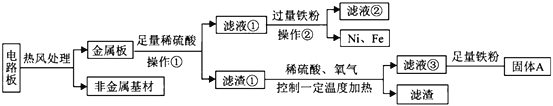
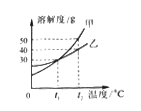
题目内容
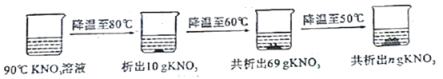
【题目】实验室有一包含杂质的碳酸氢钠样品100g(杂质不含钠元素,受热不变化),其中钠元素质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为87.6g,则分解的碳酸氢钠占原碳酸氢钠的质量分数为(2NaHCO3![]() Na2CO3 + H2O + CO2↑)
Na2CO3 + H2O + CO2↑)
A. 33.6% B. 40% C. 47.3% D. 60%
【答案】B
【解析】设样品中碳酸氢钠的质量分数是x,则100g×x×![]() =100g×23%,解得x=84%
=100g×23%,解得x=84%
样品中碳酸氢钠的质量为:100g×84%=84g
设分解的碳酸氢钠的质量是y
2NaHCO3![]() Na2CO3 + H2O + CO2↑ 反应前后固体的差量
Na2CO3 + H2O + CO2↑ 反应前后固体的差量
![]() 2×84 106 2×84-106=62
2×84 106 2×84-106=62
y 100g-87.6g=12.4g
![]() =
=![]() ,解得y=33.6g
,解得y=33.6g
分解的碳酸氢钠占原碳酸氢钠的质量分数为:![]() ×100%=40%,故选B。
×100%=40%,故选B。

练习册系列答案
相关题目
【题目】已知下列元素在化合物中的化合价,利用下列元素写出符合要求的物质的化学式。
+1 H | -2 O | +4 C | +6 S | +5 N | +1 Na | +2 Cu |
(1)一种金属氧化物______;
(2)一种难溶于水的碱______;
(3)水溶液呈碱性的盐_____。
(4)如图是钾元素的部分信息,有关钾元素的说法中正确的是____
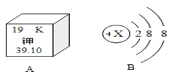
A.钾元素的相对原子质量为39.10 B.一个钾原子中有19个中子
C.钾原子结构示意图中的x=18 D.钾元素在化合物中可能显-2价
E.钾原子的最外层电子数为1 F.钾元素位于元素周期表的第3周期