题目内容
【题目】含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品H2SO4,该工艺流程如图所示,下列叙述不正确的是
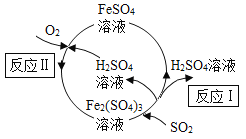
A.该过程中化合价发生改变的元素为Fe、S、O
B.涉及的反应类型有化合反应和分解反应
C.理论上,每消耗6.4 t SO2,需向体系中通入1.6 t O2
D.理论上,每生产9.8 t H2SO4,需向体系中补充Fe2(SO4)3 20 t
【答案】BD
【解析】
反应的化学方程式![]() ,
,
![]() 。
。
A、该过程中氧元素的化合价有0价和-2价,铁元素的化合价有+2价和+3价,硫元素的化合价有+4价和+6价,故A正确;
B、根据图示可知,反应Ⅰ是硫酸铁、二氧化硫和水反应生成硫酸亚铁和硫酸,反应Ⅱ是硫酸亚铁、氧气、硫酸反应生成硫酸铁和水,两者既不是化合反应,也不是分解反应,故B不正确;
C、根据化学方程式![]() ,
,
![]() ,可知,二氧化硫和氧气的关系
,可知,二氧化硫和氧气的关系![]() ,二者的质量比是128:32=4:1,所以消耗6.4t
,二者的质量比是128:32=4:1,所以消耗6.4t![]() 需要通入氧气质量为
需要通入氧气质量为![]() ;故C正确;
;故C正确;
D、根据化学方程式可知,硫酸铁是循环利用的,整个过程不消耗,所以不需要补充;故D不正确。故选BD。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,流程如下:
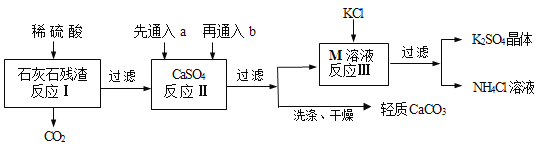
已知:CaCO3+H2O+CO2=Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____________(填序号);
①搅拌
②将残渣粉碎成细小颗粒
③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是_______________(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为___________,反应Ⅲ在常温下能实现的原因是________,生成的NH4Cl溶液在农业上可用作_______________;
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,______(①滴加稀盐酸、② 滴加Na2SO4 溶液、③ 滴加BaCl2溶液,填写序号),若无明显的现象,则已洗净;
(5)过滤器的制作如图,正确的顺序是______(填序号);
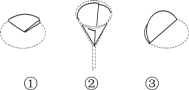
(6)该工艺流程中循环利用的物质除了水,还有_________________________。
【题目】(9分)某学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。

【提出问题】氢氧化钠能否与二氧化碳反应?
【猜想与假设】亮亮同学认为氢氧化钠能与二氧化碳反应;莉莉同学认为氢氧化钠不能与二氧化碳反应。
【设计与实验】亮亮同学设计了两个装置并进行实验。请你和他一起验证他的猜想。
实验步骤 | 实验现象 | 实验结论 |
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | ||
如图二, |
【反思与评价】莉莉同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
【设计与实验】请你设计一个实验,证明氢氧化钠确实与二氧化碳反应。
实验步骤 | 实验现象 | 实验结论 |
氢氧化钠与二氧化碳反应 |
【交流与提高】实验证明氢氧化钠还能与二氧化硫反应,化学方程式为:
2NaOH+SO2=X+H2O,X的化学式是 。