题目内容
【题目】某同学配制50g 6%的氯化钠溶液,整个操作过程中如下图所示,回答下列问题:

(1)配制溶液的正确操作顺序为________(填序号,下同),其中操作错误的是_______。
(2)图②中盛放氯化钠固体的仪器名称是______________,需称取氯化钠__________g。
(3)量水时选用的量筒的量程最合适的是______(填序号),读数时视线要与量筒内_________保持水平。
A.10mL B.25mL C.50mL D.100mL
(4)取上述溶液10g加水________g,可稀释得到3%的NaCl溶液。
(5)若该同学配制的溶液溶质质量分数偏小,可能的原因是____________(填序号)。
A.氯化钠固体不纯 B.用生锈砝码称量
C.装瓶时有少量溶液洒出 D.溶解前烧杯内有少量水
【答案】 ②①⑤③④ ① 广口瓶 3或3.0 C 凹液面最低处 10 AD
【解析】(1)配制溶液的操作顺序为:取固体药品,称量固体的质量,转移,量取液体体积,搅拌溶解,故正确顺序为:②①⑤③④ ;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶,50g 6%的氯化钠溶液中溶质的质量为:50g![]() 需称取氯化钠3g;
需称取氯化钠3g;
(3)50g 6%的氯化钠溶液中水的质量为50g-3g=47g,经计算水的体积为47mL,故选用50mL的量筒;读数时视线要与凹液面最低处相平;
(4)10g6%的氯化钠溶液中氯化钠的质量为10g![]() 0.6g,0.6g3%的氯化钠溶液的质量为:0.6g
0.6g,0.6g3%的氯化钠溶液的质量为:0.6g![]() 3%=20g,故加入水的质量为20g-10g=10g;
3%=20g,故加入水的质量为20g-10g=10g;
(5)A、氯化钠固体不纯使得溶液中溶质的质量减少,故溶质的质量分数减少,正确;
B、用生锈砝码称量氯化钠,称量的氯化钠偏大,故溶液中溶质的质量分数偏大,错误;
C、装瓶时有少量溶液洒出只能使溶液的总质量减少,溶质的质量分数不变,错误;
D、溶解前烧杯内有少量水,配得的溶液中溶剂的质量偏大,故溶液中溶质的质量分数偏小,正确。故选AD。

【题目】(l)以下是有关CO2气体溶解度的几组数据:
CO2在水中的溶解度(单位:ml)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据分析:
① 根据CO2在水中的溶解度表,叙述外界条件是如何影响气体溶解度的?_____、______;
② 打开可乐瓶有气体溢出,说明原瓶中的压强_____(填:小于、等于或大于)瓶外大气压强。
(2)右下图是无结晶水合物的固体甲和乙在水中的溶解度曲线,请根据该曲线图回答下列问题:
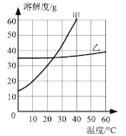
① 20℃时,150g水中溶解______g甲物质恰好形成饱和溶液。
② 现有60℃的乙的饱和溶液,与该溶液有关的量有:
A.水的质量 B.溶液中溶质的质量 C.溶液的质量
D.乙的质量分数 E.60℃时乙的溶解度
保持温度不变,将该饱和溶液稀释,不变的量是_(填序号,下同);如果将该饱和溶液降温至20℃,不变的量是_________。