题目内容
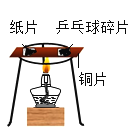
【题目】空气是人类活动必需的自然资源。工业上常用分离空气的方法制取氧气,如图![]() 所示,实验室常用物质分解的方法制取氧气。
所示,实验室常用物质分解的方法制取氧气。
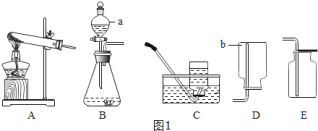
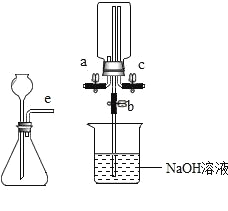
(1)写出标有序号的仪器名称:a_____,b_____。
(2)在实验室中用过氧化氢溶液和二氧化锰混合制取并收集氧气,可选择_____装置(填字母代号)。
(3)学习了MnO2对过氧化氢分解有催化作用的知识后。某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了如下探究。
(猜想)I、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
II、CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
III、CuO是反应的催化剂,反应前后_____。
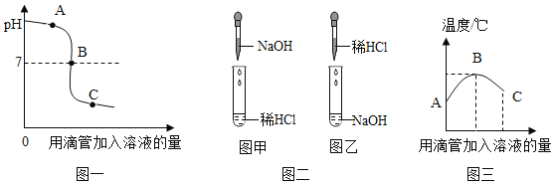
(实验)用天平称量0.2gCuO,取5mL5%过氧化氢溶液于试管中,进行如图2实验:
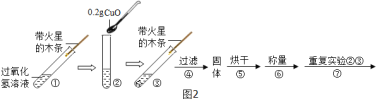
(一)填表:
步骤③现象 | 步骤⑥结果 | 结论 |
_____ | _____ | 猜想I、II不成立 猜想III成立 |
(二)步骤①的目的是_____;
(三)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、_____;
(四)过氧化氢能被CuO催化分解放出O2的化学方程式为_____。
(拓展)要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶液固体,观察是否能生成蓝色溶液。
【答案】分液漏斗 集气瓶 BC或BE 质量和化学性质都不变 带火星的木条复燃 固体质量是0.2g 与②进行对比 玻璃棒 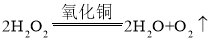
【解析】
(1)据图可知仪器a是分液漏斗,![]() 是集气瓶;
是集气瓶;
(2)在实验室中用过氧化氢溶液和二氧化锰混合制取并收集氧气不需要加热,应该用B装置作为发生装置;因为氧气的密度比空气大,可以用向上排空气法收集,即用E装置收集,氧气不易溶于水,可以用排水法收集,即用C装置收集;
(3)![]() 是反应的催化剂,反应前后质量和化学性质都不变;
是反应的催化剂,反应前后质量和化学性质都不变;
[实验](二)步骤①的目的是与②进行对比,通过比较可以判断氧化铜的作用;
(三)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯和玻璃棒;
(四)过氧化氢能被CuO催化分解放出O2的化学方程式为: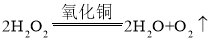 。
。

 阅读快车系列答案
阅读快车系列答案【题目】甲烷(CH4)气体难溶于水,不与浓硫酸、硫酸铜、碱石灰(氢氧化钠和氧化钙的固体混合物)、澄清石灰水等起反应.甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳.某化学小组为验证甲烷的组成,设计了如图所示实验.该实验装置气密性良好,实验中所用试剂均足量.
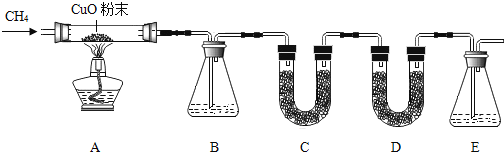
已知装置B、C、D、E中分别盛有浓硫酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色.
(1)实验步骤:
I.通入甲烷气体.
II.点燃酒精灯加热,反应一段时间后,停止加热.
III.继续通甲烷至玻璃管冷却.
(2)有关现象:
①A中黑色固体变红色;②中C中未见变蓝色;③E中未见出现浑浊.
(3)有关数据:
A中玻璃管及物质总质量/g | B装置及物质总质量/g | D装置及物质总质量/g | |
反应前 | 108.0 | 212.0 | 131.0 |
反应后 | 106.4 | 212.9 | 132.1 |
请回答下列问题:
(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与____相同.
A 用石灰石与稀盐酸制二氧化碳 B 用过氧化氢制氧气 C 用高锰酸钾制氧气
(2)甲烷还原氧化铜的化学方程式为_____.
(3)实验过程中通入甲烷的作用各不相同.步骤I是___;步骤II是还原氧化铜;步骤III是___.
(4)请根据该实验数据列计算式,证明甲烷中不含氧元素.相关计算式为_____.