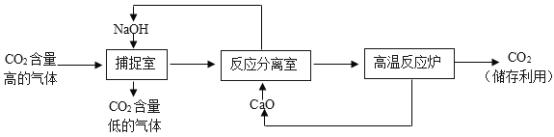
题目内容
【题目】如图是稀盐酸和氢氧化钠反应发生过程中各项的变化,请
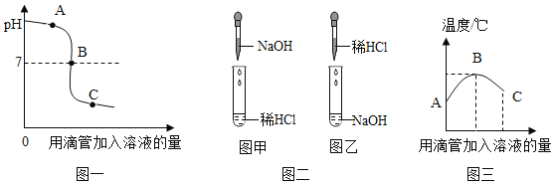
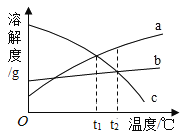
(1)根据pH值变化图一判断,该反应的实验过程是按照图二中的图_____(填“甲”或“乙”)进行。
(2)图三中的B点,说明该反应伴随_____现象(填“放热”或“吸热”)。
(3)图三C点所得溶液中,含有的溶质是__________(填化学式)。
(4)在没有指示剂的情况下,下列试剂不能帮助确定上述反应是否发生的是_____。
a.铁粉 b.AgNO3溶液 c.Na2CO3溶液
【答案】乙 放热 NaCl、HCl b
【解析】
(1)由图1可知,溶液由碱性变为酸性溶液,故为碱中加酸,故选:乙。
(2)溶液温度,随着盐酸滴加温度升高,说明该反应放热,故填:放热。
(3)溶液温度,随着盐酸滴加温度升高,说明该反应放热,B点温度最高氢氧化钠和盐酸恰好完全反应,C点表示盐酸过量,溶质为氯化钠、氯化氢,故填:NaCl、HCl。
(4)a假如盐酸和氢氧化钠没有发生反应,加入铁粉,铁粉和盐酸生成浅绿色氯化亚铁溶液和氢气,假如盐酸和氢氧化钠发生反应再加入铁粉,无现象,根据现象可判定盐酸和氢氧化钠是否发生反应,不符合题意。
b假如盐酸和氢氧化钠反应生成氯化钠和水,氯化钠和硝酸银生成白色沉淀,假如盐酸和氢氧化钠没有发生反应,盐酸和硝酸银也生成白色沉淀,盐酸和氢氧化钠反应不反应加硝酸银都生成白色沉淀,根据现象无法判定盐酸和氢氧化钠是否发生反应,符合题意。
c假如盐酸和氢氧化钠没有发生反应,加入碳酸钠,碳酸钠和盐酸生成氯化钠二氧化碳和水,假如盐酸和氢氧化钠发生反应会生成氯化钠和水,再加入碳酸钠,无现象,根据现象可判定盐酸和氢氧化钠是否发生反应,不符合题意。
故选:b。

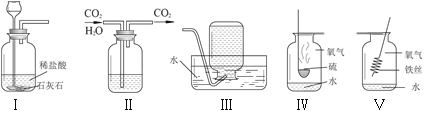
【题目】空气是人类活动必需的自然资源。工业上常用分离空气的方法制取氧气,如图![]() 所示,实验室常用物质分解的方法制取氧气。
所示,实验室常用物质分解的方法制取氧气。
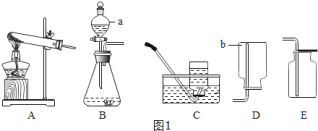
(1)写出标有序号的仪器名称:a_____,b_____。
(2)在实验室中用过氧化氢溶液和二氧化锰混合制取并收集氧气,可选择_____装置(填字母代号)。
(3)学习了MnO2对过氧化氢分解有催化作用的知识后。某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了如下探究。
(猜想)I、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
II、CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
III、CuO是反应的催化剂,反应前后_____。
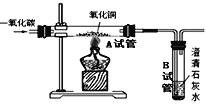
(实验)用天平称量0.2gCuO,取5mL5%过氧化氢溶液于试管中,进行如图2实验:
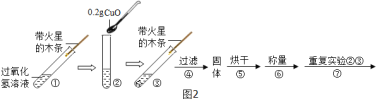
(一)填表:
步骤③现象 | 步骤⑥结果 | 结论 |
_____ | _____ | 猜想I、II不成立 猜想III成立 |
(二)步骤①的目的是_____;
(三)步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、_____;
(四)过氧化氢能被CuO催化分解放出O2的化学方程式为_____。
(拓展)要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶液固体,观察是否能生成蓝色溶液。