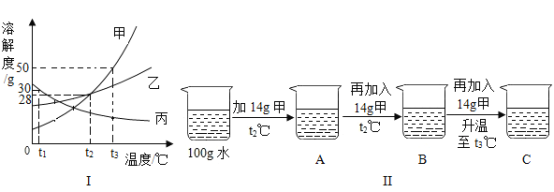
题目内容
【题目】某食用碱的主要成分是 ![]() ,其中含有少量的 NaCl,小明同学为测定该食用碱中
,其中含有少量的 NaCl,小明同学为测定该食用碱中 ![]() 的质量分数,他进行了以下实验,取60g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的
的质量分数,他进行了以下实验,取60g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的![]() 溶液,实验数据见表:
溶液,实验数据见表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱溶液的质量 | 100g | 100g | 100g | 100g |
加入 | 20g | 40g | 60g | 80g |
生成沉淀的质量 | 3g | 6g | m | 10g |
请分析表中数据并计算回答。
(1)m=______;
(2)该60g食用碱配成的溶液与足量![]() 溶液反应,最多生成沉淀质量为_______g;
溶液反应,最多生成沉淀质量为_______g;
(3)该食用碱中 ![]() 的质量分数是多少_______?(写出计算过程,答案精确到
的质量分数是多少_______?(写出计算过程,答案精确到 ![]() )
)
【答案】(1)9 (2)40 (3)70.7%
【解析】
(1)根据表格中的数据可知,加入20g的CaCl2溶液,若氯化钙溶液能完全反应,就能得到3g的沉淀。加入20g的氯化钙溶液得到了3g的沉淀,说明氯化钙反应完全。加入40g的氯化钙溶液得到了6g的沉淀,说明氯化钙反应完全。加入了60g的氯化钙溶液,若氯化钙完全反应,则应该得到9g的沉淀。加入80g的氯化钙,得到了10g的沉淀,则说明此时氯化钙有剩余,没有完全被反应。那么加入60g的氯化钙溶液,应该完全反应,则产生的沉淀质量为9g。故答案为:9;
(2)根据(1)可知,实验一中,食用碱有剩余。实验二中,食用碱有剩余。实验三中,食用碱有剩余。实验四中,氯化钙溶液有剩余。题干中描述“该60g食用碱配成的溶液与足量的CaCl2溶液反应”,则可以分析出最后得到的溶液中,氯化钙有剩余。则根据实验四可知,100g的食用碱溶液中,含有食用碱的质量为:60g÷4=15g,则15g的食用碱固体最多能产生10g的沉淀。则60g的食用碱,最多能产生40g的沉淀。故答案为:40;
(3)根据(1)分析可知,只有实验四的碳酸钠被完全消耗,所以应该选择实验四的数据。否则其他组实验的数据只能计算出参加反应的碳酸钠的质量,无法求出未反应的碳酸钠的质量。
解:设食用碱中Na2CO3的质量为x。

解得x=10.6g。
根据题意可知,60g的食用碱和水配成400g的溶液,则每份溶液中食用碱的质量为:60g÷4=15g。
则食用碱中碳酸钠的质量分数为:![]() 。
。